
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Ni、Si、P等元素)制备,回答下面问题:
(1)钴元素在元素周期表中的位置____。![]() 与硫元素位于同一主族,其价层电子排布式是___。
与硫元素位于同一主族,其价层电子排布式是___。
(2)MnSO4中阴离子的空间构型是____中心原子的杂化类型______。
(3)比较H2S ______H2Se热稳定性:(填“>”“<”)判断依据是______;比较沸点:N2H4 _____P2H4 (填“>”“<”),判断依据是______。
(4) FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(FeCl3)2存在,画出其结构并标出配位键__________。
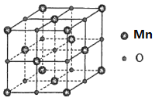
(5)MnO具有NaCl型结构(如图),其中阳离子采用面心立方最密堆积方式,设其晶胞参数为apm,则r(Mn2+)为______pm晶胞密度是_____g/cm3(用含a的表达式表示)
【答案】第四周期第VIII族 7s27p4 正四面体 sp3 > S的非金属性强于Se > N2H4分子间形成氢键 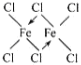
![]() a
a ![]()
【解析】
(1)钴元素为27号元素,位于第四周期第VIII族;![]() 质子数为116,则其原子核外有116个电子,则其电子层结构为2,8,18,32,32,18,6,位于第七周期,与S元素位于同一主族,则其价电子排布为7s27p4;
质子数为116,则其原子核外有116个电子,则其电子层结构为2,8,18,32,32,18,6,位于第七周期,与S元素位于同一主族,则其价电子排布为7s27p4;
(2)硫酸锰中阴离子为SO![]() ,中心原子价层电子对数为
,中心原子价层电子对数为![]() =4,不含孤电子对,所以空间构型为正四面体形,中心原子采取sp3杂化;
=4,不含孤电子对,所以空间构型为正四面体形,中心原子采取sp3杂化;
(3)S和Se位于同一主族,同主族元素自上而下非金属性减弱,所以非金属性:S>Se,则简单氢化物的稳定性H2S>H2Se;N2H4能形成分子间氢键,P2H4分子间不能形成氢键,所以沸点:N2H4>P2H4;
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(FeCl3)2存在,与AlCl3相似,氯原子提供孤电子对,Fe原子提供空轨道形成配位键,其结构式为 (“→”表示出其中的配位键);
(“→”表示出其中的配位键);
(5)阳离子采用面心立方最密堆积方式,即Mn2+为面心立方最密堆积,则位于面对角线上的Mn2+相切,所以有4r(Mn2+)=![]() a pm,所以r(Mn2+)=
a pm,所以r(Mn2+)=![]() a pm;根据均摊法,晶胞中Mn2+的个数为
a pm;根据均摊法,晶胞中Mn2+的个数为![]() =4,晶体化学式为MnO,则O2-的个数也为4,所以晶胞的质量m=
=4,晶体化学式为MnO,则O2-的个数也为4,所以晶胞的质量m=![]() ,晶胞棱长为a pm,则晶胞的体积V=a3pm3=(a×10-10)3cm3,所以晶体的密度为
,晶胞棱长为a pm,则晶胞的体积V=a3pm3=(a×10-10)3cm3,所以晶体的密度为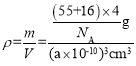 =
=![]() g/cm3。
g/cm3。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+4B(g)![]() 2C(g)+2D(g),下列数据表示反应进行得最快的是( )
2C(g)+2D(g),下列数据表示反应进行得最快的是( )
A.v(A)=1.4mol/(Ls)B.v(B)=3.6 mol/(Ls)
C.v(C)=2mol/(Ls)D.v(D)=30 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下表模型并结合有关信息,判断下列说法中不正确的是( )
B12结构单元 | SF6分子 | S8分子 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点1873 K | — | 易溶于CS2 | — |
A.单质硼属于原子晶体,每个B12结构单元中含有30个B—B键和20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H—C≡N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,容器A、B的容积相等,K为开关,活塞可以左右移动。一定温度下,关闭K,向容器A中通入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)ΔH<0。则下列说法不正确的是( )
N2O4(g)ΔH<0。则下列说法不正确的是( )

A.保持活塞位置不变,打开K,体系中气体的颜色先变浅,然后略加深
B.打开K,一段时间后再关闭K,向右推动活塞,最终容器A中气体的颜色比容器B中的浅
C.保持活塞位置不变,打开K,一段时间后再关闭K,加热容器A,容器A中气体的颜色比容器B中的深
D.打开K,一段时间后再关闭K,向容器B中通入氩气,容器B中气体的颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,已知E1=+134kJ·mol-1、E2=+368kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:________。

(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
a:2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5kJ·mol-1
b:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
c:H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:

下列说法正确的是
A. 该反应的△H<O
B. X 点CH4的转化率为20%
C. X点与Y点容器内压强比为55:51
D. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1mol 时V(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )


A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在4个体积均为 1.0 L的恒容密闭容器中反应2SO2(g)+O2 (g)![]() 2SO3(g) 达到平衡。
2SO3(g) 达到平衡。
下列说法正确的是
容器 | 温度/K | 物质的起始浓度/moI/L | 物质的平衡浓度moI/L | O2或SO3平衡转化率 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
Ⅰ | 723 | 0.2 | 0.2 | 0 | 0.04 | α1 |
Ⅱ | 723 | 0 | 0.1 | 0.2 | α2 | |
Ⅲ | 723 | 0.4 | 0.4 | 0 | α3 | |
IV | 823 | 0 | 0.1 | 0.2 | α4 | |
A. 达到平衡时, α1+α2=1
B. 达到平衡时,容器中的压强:PⅠ>PIV
C. 达到平衡时,逆反应速率容器IV中比容器Ⅰ中的大
D. 达平衡后,再向容器Ⅰ中充入0.16 mol SO2、0.04 mol SO3,则此时反应向逆反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com