
【题目】一定温度下,在4个体积均为 1.0 L的恒容密闭容器中反应2SO2(g)+O2 (g)![]() 2SO3(g) 达到平衡。
2SO3(g) 达到平衡。
下列说法正确的是
容器 | 温度/K | 物质的起始浓度/moI/L | 物质的平衡浓度moI/L | O2或SO3平衡转化率 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
Ⅰ | 723 | 0.2 | 0.2 | 0 | 0.04 | α1 |
Ⅱ | 723 | 0 | 0.1 | 0.2 | α2 | |
Ⅲ | 723 | 0.4 | 0.4 | 0 | α3 | |
IV | 823 | 0 | 0.1 | 0.2 | α4 | |
A. 达到平衡时, α1+α2=1
B. 达到平衡时,容器中的压强:PⅠ>PIV
C. 达到平衡时,逆反应速率容器IV中比容器Ⅰ中的大
D. 达平衡后,再向容器Ⅰ中充入0.16 mol SO2、0.04 mol SO3,则此时反应向逆反应方向进行
【答案】C
【解析】
A.Ⅰ和II属于等效平衡,只是加料的方向不同,因为转化率=变化量/初始量。Ⅰ和II不是按着化学反应计量数之比加料的,所以平衡时转化率α1+α2![]() 1,故A错误;B.Ⅰ和IV投料相当,在相同温度下可以达到等效平衡,但是IV温度高,此反应是放热反应,所以升高温度,平衡逆向移动,故达到平衡时,容器中的压强:PⅠ<PIV,故B错误;C. Ⅰ和IV相比相当于达到等效平衡后IV又升高温度了,温度升高后化学反应速率加快,所以IV 达到平衡时,逆反应速率比容器Ⅰ中的大,故C正确;
1,故A错误;B.Ⅰ和IV投料相当,在相同温度下可以达到等效平衡,但是IV温度高,此反应是放热反应,所以升高温度,平衡逆向移动,故达到平衡时,容器中的压强:PⅠ<PIV,故B错误;C. Ⅰ和IV相比相当于达到等效平衡后IV又升高温度了,温度升高后化学反应速率加快,所以IV 达到平衡时,逆反应速率比容器Ⅰ中的大,故C正确;
D. 2SO2(g)+O2(g) 2SO3(g)
起始量(mol/L) 0.2 0.2 0
变化量(mol/L) 0.04 0.02 0.04
平衡量(mol/L) 0.16 0.18 0.04
K=0.042/(0.162×0.18)=0.35,若达平衡后,再向容器Ⅰ中充入0.16 mol SO2、0.04 mol SO3,因体积为1L,所以浓度商为Qc=0.082/(0.322×0.18)=0.35=K,所以平衡不移动。故D错误;答案为:C。


科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe + 2Ag+=Fe2+ + 2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①取少量黑色固体,洗涤后,____________________________________(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加__________溶液,产生蓝色沉淀,说明溶液中含有_____________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是________________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,白色沉淀:___________(化学式),且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
i | 3 | 产生大量白色沉淀;溶液呈红色 |
ii | 30 | 产生白色沉淀较3min时量少;溶液红色较3min时加深 |
iii | 120 | 产生白色沉淀较30min时量少;溶液红色较30min时变浅 |
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________________________(用离子方程式表示),可产生Fe3+; 假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+_________________(用离子方程式表示)
假设d:根据加入KSCN溶液后产生白色现象,判断溶液中存在Ag+,可产生Fe3+。请写出产生Fe3+的离子方程式:______________________________。
③ 下列实验可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验:向硝酸酸化的__________溶液溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是“化学元素周期表国际年”,有关118号元素295Og说法错误的是( )
A.原子核外电子数为118B.是零族元素
C.位于第六周期D.原子的质量数为295
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物 A——G之间存在如下转化关系,除D以外其他物质均为芳香族化合物,其中化合物B分子中含有一个甲基,化合物D完全燃烧生成等物质的量的CO2 和H2O ,且D蒸汽与氢气的相对密度为30。回答下列问题:
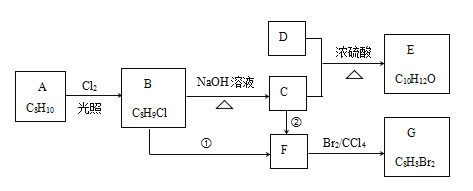
(1)化合物A的名称__________________,化合物D的分子式为_____________。
(2)① 的反应类型为 _____________。
② 需要的试剂和反应条件是______________________。
(3)C中含氧官能团的名称为___________。F的结构简式为___________。
(4)C + D![]() E的化学方程式为_____________________。
E的化学方程式为_____________________。
(5)同时符合下列条件的E的同分异构体有_____种,其中分子中有五种不同化学环境的氢,数目比为1:1:2:2:6 的结构简式为________________。
①苯环上有两个侧链 ②分子中含有两个甲基
③能发生水解反应且水解产物能使氯化铁溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较,错误的是
A.金属性:Mg>AlB.稳定性:HF>HCl
C.碱性:NaOH>Mg(OH)2D.酸性:H2SO4>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能。下列说法中不正确的是
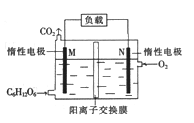
A. M极作负极,发生氧化反应
B. 电子流向:M→负载→N→电解质溶液→M
C. N极的电极反应:O2+4H++4e-=2H2O
D. 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系的压强不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥B. ①③④⑥C. ②③④⑥D. ①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com