
【题目】某小组在验证反应“Fe + 2Ag+=Fe2+ + 2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①取少量黑色固体,洗涤后,____________________________________(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加__________溶液,产生蓝色沉淀,说明溶液中含有_____________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是________________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,白色沉淀:___________(化学式),且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
i | 3 | 产生大量白色沉淀;溶液呈红色 |
ii | 30 | 产生白色沉淀较3min时量少;溶液红色较3min时加深 |
iii | 120 | 产生白色沉淀较30min时量少;溶液红色较30min时变浅 |
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________________________(用离子方程式表示),可产生Fe3+; 假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+_________________(用离子方程式表示)
假设d:根据加入KSCN溶液后产生白色现象,判断溶液中存在Ag+,可产生Fe3+。请写出产生Fe3+的离子方程式:______________________________。
③ 下列实验可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验:向硝酸酸化的__________溶液溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______________________________________________________________________________。
【答案】加入足量稀盐酸(或稀硫酸),固体未完全溶解铁氰化钾(或K3[Fe(CN)3] ) Fe2+Fe+2Fe3+=3Fe2+ AgSCN4Fe2++O2+4H+=Fe3++2H2O3Fe2+ + NO3- + 4H+ =3Fe3+ +NO↑+ 2H2OAg++Fe2+=Ag+Fe3+NaNO3溶液中存在反应:①Fe+2Ag+=Fe2++2Ag,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①②为主,c(Fe3+)增大。约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。
【解析】
(1)银和盐酸、稀硫酸等不反应,可用K3[Fe(CN)3]检验亚铁离子,生成蓝色沉淀;
(2)过量的铁与硝酸反应生成亚铁离子,亚铁离子可被空气中氧气氧化,可被酸化的硝酸根离子氧化,银离子如氧化亚铁离子,则发生Ag++Fe2+=Ag+Fe3+;
(3)取上层清液,滴加KSCN溶液,溶液变红,可证明溶液中有Fe3+,生成白色沉淀为AgSCN,随着放置时间的增加,平衡Ag++SCN-![]() AgSCN逆向移动,Fe3+浓度减小,溶液红色变浅,主要发生Fe+2Fe3+=3Fe2+。
AgSCN逆向移动,Fe3+浓度减小,溶液红色变浅,主要发生Fe+2Fe3+=3Fe2+。
(1)①黑色固体中含有过量铁,如果同时含有银,则可以加入HCl或H2SO4溶解Fe,而银不能溶解;
②K3[Fe(CN)3]是检验Fe2+的试剂,所以产生蓝色沉淀说明含有Fe2+;
(2)过量铁粉与Fe3+反应生成Fe2+,即Fe+2Fe3+=3Fe2+;
①Ag+与SCN-生成白色沉淀AgSCN;
②O2氧化Fe2+反应为4Fe2++O2+4H+=4Fe3++2H2O,白色沉淀是AgSCN,所以实验可以说明含有Ag+,Ag+可能氧化Fe2+生成Fe3+;
酸性溶液中NO3-具有氧化性,可产生Fe3+,3Fe2+ + NO3- + 4H+ =3Fe3+ +NO↑+ 2H2O;
银离子氧化亚铁离子,则发生Ag++Fe2+=Ag+Fe3+;
③证明假设abc错误,就是排除Ag+时实验比较,相当于没有Ag+存在的空白实验,考虑其他条件不要变化,可以选用0.05 mol·L-1NaNO3;
(3)溶液中存在反应:①Fe+2Ag+=Fe2++2Ag,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①②为主,c(Fe3+)增大。随反应进行平衡Ag++SCN-![]() AgSCN逆向移动,约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。
AgSCN逆向移动,约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】最近华人女科学家鲍哲南教授领导的团队开发出了一种导电性和拉伸性俱佳的高分子材料,用于可拉伸塑料电极。下列材料属于高分子材料的是
A.聚乙烯B.陶瓷C.玻璃D.石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,不属于化学变化的是( )
A.活性炭使红墨水褪色B.FeSO4溶液使酸性高锰酸钾溶液褪色
C.氯水使有色布条褪色D.SO2使品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。利用电化学原理将CO、SO2转化为重要化工原料, 装置如图所示。
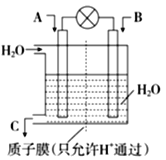
①若A为CO, B为H2,C为CH3OH,则通入CO一极的电极反应式为_____________。
②A为SO2, B为O2, C为H2SO4, 则负极反应式为________________。
③若A为NO2, B为O2, C为HNO3,负极的电极反应式为_________________。
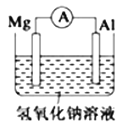
(2)下图所示的原电池装置中,负极材料是_____。正极上能够观察到的现象是_______________。 负极的电极反应式是_________________。原电池工作一段时间后,若消耗负极5.4g ,则放出气体______mol。
(3)利用反应Cu + Fe2(SO4)3=2FeSO4 + CuSO4设计一个原电池。
①在下面方格内画出实验装置图________________。

②指出正极材料可以为_____,该电极上发生的电极反应为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关一定物质的量浓度溶液的配制说法中正确的是 ( )
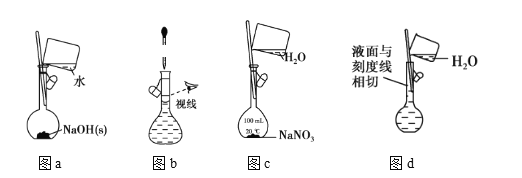
(1)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用胶头滴管滴加蒸馏水至刻度线
(2)利用图a配制0.10molL-1NaOH溶液
(3)利用图b配制一定浓度的NaCl溶液
(4)利用图c配制一定物质的量浓度的NaNO3溶液
(5)用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余液体
(6)配制溶液定容时,仰视视容量瓶刻度会使溶液浓度偏低
(7)配制溶液的定容操作可以用图d表示
A. ⑵⑸ B. ⑴⑹ C. ⑴⑷⑹ D. ⑴⑶⑸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在4个体积均为 1.0 L的恒容密闭容器中反应2SO2(g)+O2 (g)![]() 2SO3(g) 达到平衡。
2SO3(g) 达到平衡。
下列说法正确的是
容器 | 温度/K | 物质的起始浓度/moI/L | 物质的平衡浓度moI/L | O2或SO3平衡转化率 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
Ⅰ | 723 | 0.2 | 0.2 | 0 | 0.04 | α1 |
Ⅱ | 723 | 0 | 0.1 | 0.2 | α2 | |
Ⅲ | 723 | 0.4 | 0.4 | 0 | α3 | |
IV | 823 | 0 | 0.1 | 0.2 | α4 | |
A. 达到平衡时, α1+α2=1
B. 达到平衡时,容器中的压强:PⅠ>PIV
C. 达到平衡时,逆反应速率容器IV中比容器Ⅰ中的大
D. 达平衡后,再向容器Ⅰ中充入0.16 mol SO2、0.04 mol SO3,则此时反应向逆反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com