
【题目】最近华人女科学家鲍哲南教授领导的团队开发出了一种导电性和拉伸性俱佳的高分子材料,用于可拉伸塑料电极。下列材料属于高分子材料的是
A.聚乙烯B.陶瓷C.玻璃D.石墨
科目:高中化学 来源: 题型:
【题目】医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题: H++ Mn![]() + H2C2O4→ CO2↑+Mn2++
+ H2C2O4→ CO2↑+Mn2++
(1)配平以上离子方程式,并在□中填上所需的微粒_____________________________。
(2)该反应中的还原剂是_____(填化学式)。
(3)反应转移了0.4 mol电子,则消耗KMnO4的物质的量为_________ mol。
(4)测定血钙含量的方法是:取2 mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是________________________。
②溶解沉淀时______(填“能”或“不能”)用稀盐酸,原因是__________。
③若消耗了1.0×10-4 mol·L-1的KMnO4溶液20.00 mL,则100 mL该血液中含钙 _____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1894年,Fenton发现采用Fe2+和H2O2混合溶液,能产生具有高反应活性和强氧化性的羟基自由基(-OH),从而氧化降解有机污染物,称为Fenton反应。电Fenton法采用惰性电极电解法,右图为其中一个电极的反应机理,其中含有Fenton反应。下列说法不正确的是( )
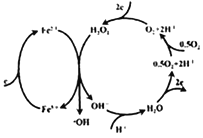
A. 羟基自由基(-OH)的电子式为:![]()
B. 右图所在的惰性电极应与外接电源的负极相连
C. Fenton反应:Fe2++H2O2==Fe3++OH-+-OH
D. 右图所在的惰性电极每消耗22.4LO2(标准状况),理论上在外电电路中转移4mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题:
(1)写出实验室用固体加热型装置制取氨气的化学方程式 __________。
(2)要得到干燥的氨气可选用____作干燥剂。
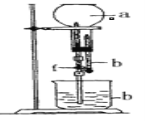
A.碱石灰(CaO和NaOH的混合物)
B.浓硫酸
C.浓硝酸
D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体步骤如下:

①包装:取滤纸制成滤纸筒,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作a;在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作b。
②萃取:将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水,加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h)。
③称量:萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发,待无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作c。
回答下列问题:
(1)实验中三次使用的仪器X的名称为__________________。为提高乙醚蒸气的冷凝效果,索氏提取器可选用下列_______(填字母)代。
![]()
![]()
![]()
a.空气冷凝管 b.直形冷凝管 c.蛇形冷凝管
(2)实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入的药品为_______(填字母)。
a.活性炭 b.碱石灰 c.P2O5 d.浓硫酸
无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是______________________________________。
(3)实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是_______。当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提筒中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶)的物理现象为_______。索氏提取法与一般萃取法相比较,其优点为___________________________。
(4)数据处理:样品中纯脂肪百分含量_________(填“<”、“>”或“=”)(b-c)/(b-a)×100%;测定中的样品、装置、乙醚都需要进行脱水处理,否则导致测定结果__________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途对应关系正确的是
A.SiO2熔点高硬度大,可用作光导纤维
B.Al2O3是两性氧化物,可用作耐高温材料
C.稀硫酸具有酸性,可用于除去铁锈
D.SO2具有氧化性,可用于纸浆漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. 水加热到很高温度都难分解是因水分子间存在氢键
B. C2H2分子中σ键与π键的数目比为1∶1
C. CS2为V形极性分子
D. SiF4与SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe + 2Ag+=Fe2+ + 2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①取少量黑色固体,洗涤后,____________________________________(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加__________溶液,产生蓝色沉淀,说明溶液中含有_____________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是________________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,白色沉淀:___________(化学式),且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
i | 3 | 产生大量白色沉淀;溶液呈红色 |
ii | 30 | 产生白色沉淀较3min时量少;溶液红色较3min时加深 |
iii | 120 | 产生白色沉淀较30min时量少;溶液红色较30min时变浅 |
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________________________(用离子方程式表示),可产生Fe3+; 假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+_________________(用离子方程式表示)
假设d:根据加入KSCN溶液后产生白色现象,判断溶液中存在Ag+,可产生Fe3+。请写出产生Fe3+的离子方程式:______________________________。
③ 下列实验可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验:向硝酸酸化的__________溶液溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com