
【题目】医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题: H++ Mn![]() + H2C2O4→ CO2↑+Mn2++
+ H2C2O4→ CO2↑+Mn2++
(1)配平以上离子方程式,并在□中填上所需的微粒_____________________________。
(2)该反应中的还原剂是_____(填化学式)。
(3)反应转移了0.4 mol电子,则消耗KMnO4的物质的量为_________ mol。
(4)测定血钙含量的方法是:取2 mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是________________________。
②溶解沉淀时______(填“能”或“不能”)用稀盐酸,原因是__________。
③若消耗了1.0×10-4 mol·L-1的KMnO4溶液20.00 mL,则100 mL该血液中含钙 _____g。
【答案】6 2 5 10 2 8 H2OH2C2O40.08CaC2O4+H2SO4=CaSO4+H2C2O4不能KMnO4会氧化Cl-0.01
【解析】
根据元素守恒知,生成物中还含有水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式;失电子化合价升高的反应物是还原剂;根据高锰酸钾和转移电子之间的关系式计算;草酸钙和硫酸反应生成硫酸钙和草酸;HCl具有还原性,能被酸性高锰酸钾溶液氧化;根据原子守恒得5Ca2+-5(NH4)2C2O4-5CaC2O4-5H2C2O4-2KMnO4,所以得关系式5Ca2+-2KMnO4,根据二者之间的关系式进行计算。
(1)根据元素守恒知,生成物中还含有水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,所以MnO4-、H2C2O4的计量数分别是2、5,再结合原子守恒配平方程式为6H++2MnO4-+5H2C2O4=10CO2↑+2Mn2++8H2O;(2)失电子化合价升高的反应物H2C2O4是还原剂;(3)根据MnO4--5e-得,反应转移了0.4mol电子,则消耗KMnO4的物质的量0.4mol/5×1=0.08mol;(4)①草酸钙和硫酸反应生成硫酸钙和草酸,反应方程式为CaC2O4+H2SO4=CaSO4+H2C2O4;②HCl具有还原性,能被酸性高锰酸钾溶液氧化而造成误差,所以不能用盐酸代替;③根据原子守恒得5Ca2+---5(NH4)2C2O4---5CaC2O4---5H2C2O4---2KMnO4,所以得关系式5Ca2+---2KMnO4,设钙离子浓度为xmol/L,
5Ca2+-----2KMnO4
5mol 2mol
2.0×10-3xmol 2.0×10-6mol
5mol:2mol=2.0×10-3xmol:2.0×10-6mol,解得x=2.5×10-3mol/L, 则100mL溶液中钙的质量=40g/mol×0.1L×2.5×10-3mol/L=0.01g。


科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。
(1)Z、M、W三种元素离子半径由大到小的顺序是____(填相应的离子符号)。
(2)用电子式表示M2W的形成过程___________
(3)由M、Z两元素形成的原子个数比为1∶1化合物的化学键类型是______
(4)由X、Y、Z、W四种元素组成的一种盐A,已知:①1molA能与足量NaOH浓溶液反应生成标准状况下22.4L气体。②A能与盐酸反应产生气体B,该气体能与溴水反应。写出A的化学式____,该气体B与溴水反应的离子方程式 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于食物的酸碱性的说法正确的是
A.食物中的主要成分能与酸反应的是碱性食物
B.食物中的主要成分能与碱反应的是酸性食物
C.食物在遇到甲基橙变红的是酸性食物,遇到酚酞变红的是碱性食物
D.食物的酸碱性应当看食物在体内代谢完全后剩余物质的酸碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于①乙醇、②乙酸溶液、③石灰水三种物质的说法不正确的是( )
A.只有②能与碳酸钠溶液反应
B.只有②能与烧碱溶液反应
C.①②③都能与钠反应放出氢气
D.①与钠反应产生氢气最为缓慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
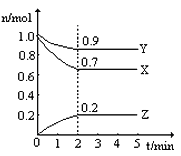
(1)该反应第_______分钟到达平衡状态 。
(2)该反应的化学方程式为____________ 。
(3)2 min时,Y的浓度为___________。
(4)反应开始至2 min,气体X的平均反应速率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现下列有机化合物转化的最佳方法是 ( )
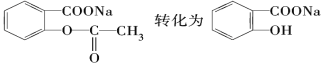
A. 与足量NaOH溶液共热后再通入足量稀硫酸
B. 与足量稀硫酸共热后再加入足量NaOH溶液
C. 与足量稀硫酸共热后再加入足量Na2CO3溶液
D. 与足量NaOH溶液共热后再通入足量CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近华人女科学家鲍哲南教授领导的团队开发出了一种导电性和拉伸性俱佳的高分子材料,用于可拉伸塑料电极。下列材料属于高分子材料的是
A.聚乙烯B.陶瓷C.玻璃D.石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com