
【题目】亚硝酸钠易溶于水,水溶液显碱性,有氧化性,也有还原性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+ ____
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:_____
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是__。从环保角度来讲,要处理NaNO2,所用的物质的___(填“氧化性”或“还原性”)应该比KI更__(填“强”或“弱”)。
(4)简便鉴别亚硝酸钠和氯化钠的方法是____。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。___
【答案】2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4 +2H2O 2NO2-+2I-+4H+ = 2NO↑ +I2 +2H2O 有NO这样的污染性气体产生 还原性 强 测定亚硝酸钠和氯化钠溶液的酸碱性,亚硝酸钠溶液显碱性,氯化钠溶液显中性 ![]()
【解析】
(1)根据反应前后的物质,判断出来反应物一定有硫酸,生成物一定有水,由化合价升降相等将方程式配平,得到总反应;
(2)方程式中只有NO、I2和H2O不能拆分为离子,其余物质都拆分为离子,得到其离子方程式;
(3)处理方法的问题是NO是一种污染性气体,所以应该选用还原性更强的还原剂,将亚硝酸钠还原为化合价更低的N2,这样就合理了;
(4)题目中已知亚硝酸钠的溶液显碱性,而氯化钠溶液一定显中性,所以可以通过测定溶液的酸碱性的方法区别两种盐溶液。
(5)氯化铵和亚硝酸钠反应得到氮气、氯化钠和水,方程式为NaNO2 +NH4Cl =N2↑+NaCl +2H2O,反应中氯化铵失电子,亚硝酸钠得电子。
(1)该反应中元素的化合价变化如下:2KI→I2,I元素的化合价由-1价→0价,I失去2e-;
NaNO2→NO,N元素的化合价由+3价→+2价,得到e-,化合价升高数=化合价降低数,所以得失电子的最小公倍数为2,所以NaNO2前的系数是2,I2前的系数是1,根据钠、钾原子守恒,K2SO4前是1,Na2SO4前是1,根据硫酸根守恒,反应物少2个H2SO4分子,据氧原子和氢原子守恒,产物水前的系数为2,所以该反应为:2NaNO2+2KI+2H2SO4═2NO↑+I2+K2SO4+Na2SO4+2H2O;
(2)根据反应方程式2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4 +2H2O得发生反应的离子方程式为2NO2-+2I-+4H+ = 2NO↑ +I2 +2H2O;
(3)一氧化氮是有毒气体,能污染大气,该反应中生成了一氧化氮,所以会造成大气污染;亚硝酸根有毒,从环保角度来讲,要处理NaNO2,所用的物质的还原性比KI更强,使其N元素化合价由+3价变为无污染的0价氮,如NaNO2+NH4Cl=NaCl+N2↑+2H2O;
(4)亚硝酸钠是强碱弱酸盐,溶液显碱性,而氯化钠溶液显中性,则鉴别亚硝酸钠和氯化钠的方法是测定亚硝酸钠和氯化钠溶液的酸碱性,亚硝酸钠溶液显碱性,氯化钠溶液显中性;
(5)氯化铵和亚硝酸钠反应得到氮气、氯化钠和水,方程式为NaNO2 +NH4Cl =N2↑+NaCl +2H2O,反应中氯化铵失电子,亚硝酸钠得电子,则用单线桥分析电子转移的方向和数目为![]() 。
。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】向100mL含HCl的AlCl3溶液中逐滴加入0.1mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:

试计算:(请写出运算过程)
(1)原溶液中HCl的物质的量浓度。____________
(2)原溶液中AlCl3的物质的量浓度。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学取三份锌粒,放入三只烧杯中,然后在甲、乙两只烧杯中分别加入2mol/L的盐酸、稀硫酸各45mL,丙烧杯中加入刚刚用5mL18mol/L的浓硫酸稀释而成的45mL稀硫酸溶液,若反应终止时,生成的气体一样多,且锌粒没有剩余。
(1)参加反应的锌的质量:甲___________乙_________丙(填“>”、“<”、“=”,下同)。
(2)反应速率,甲__________乙,原因是___________。
(3)反应完毕 所需时间:乙____________丙,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学反应方程式
(1)乙烯和水反应_______________________________________________
(2)乙醇的催化氧化反应_______________________________________________
(3)溴乙烷的消去反应_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子I的一种合成路线如下,其中D能与Na反应生成H2,且D苯环上的一氯代物有2种。
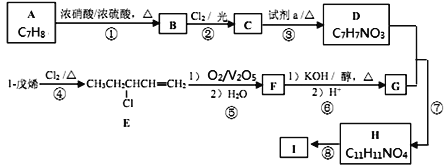
已知:![]()
回答下列问题:
(1)A的名称为________,试剂a为________________。
(2)C的结构简式为________________________。
(3)F中的官能团名称为________。
(4)上述①—⑧的反应中,不属于取代反应的是________(填数字编号)。写出反应⑦的化学方程式________________________________________。
(5)符合下列条件的B的同分异构体有________种。
①苯环上有氨基(—NH2) ②能发生银镜反应
其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的结构简式为__________。
(6)参照上述合成路线,以1-丁烯为原料(无机试剂任选),设计制备丙烯酸(CH2=CHCOOH)的合成路线________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项可以制得较纯净的CH2ClCH2Cl的是( )
A.乙烷与氯气在光照条件下反应
B.乙烯与氯化氢气体发生加成反应
C.乙烯与氯气发生加成反应
D.乙烯通入浓盐酸;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。

(1)写出CuCl2与H2S反应的离子方程式:_____。
(2)通过上述流程图的分析,整个流程的总反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所加的物质属于催化剂的是( )
A. 电解水制氢气时,加入少量的Na2SO4
B. 利用H2O2水溶液制氧气时,加入少量的MnO2固体
C. 实验室用浓盐酸制氯气时,需加入MnO2固体
D. 纯锌与硫酸反应制氢气时,滴入少量硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是

A. 左边CO和CO2分子数之比为1:3
B. 右边CO的质量为14g
C. 右边气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端![]() 处,若保持温度不变,则前后两次容器内的压强之比为5:6
处,若保持温度不变,则前后两次容器内的压强之比为5:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com