
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是

A.化合物XZW既含离子键也含共价键
B.对应气态氢化物的稳定性Y>Z
C.对应简单离子半径:X>W
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
【答案】A
【解析】
试题分析:W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素,A、化合物NaClO中钠离子与次氯酸根离子之间形成离子键,次氯酸根中氯原子与氧原子之间形成共价键,故A正确;B、非金属性Cl>Si,故氢化物稳定性Y<Z,故B错误;C、电子层结构相同核电荷数越大离子半径越小,故离子半径O2->Na+,故C错误;D、二氧化硅能与氢氧化钠反应生成硅酸钠与水,除氢氟酸外二氧化硅不溶于其它酸,不能越高氯酸反应,故D错误。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】第ⅥA族氢化物的熔沸点比较中,水最高的原因是
A. 水分子间有氢键 B. 水分子内的共价健最稳定
C. 水分子间的范德华力最大 D. 氧元素的非金属性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯在染料、医药工业中有广泛的应用,某实验小组利用如下装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯。
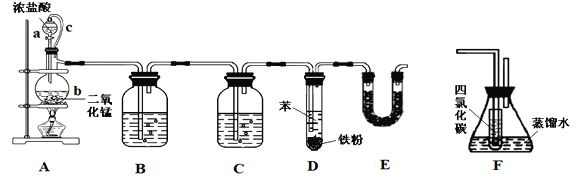
反应物和产物的相关数据列表如下:
密度/g·cm-3 | 沸点/℃ | 水中溶解性 | |
苯 | 0.879 | 80.1 | 微溶 |
氯苯 | 1.11 | 131.7 | 不溶 |
请按要求回答下列问题。
(1)装置A中橡胶管c的作用是______________,装置E的作用是__________________。
(2)实验时;使a中的浓盐酸缓缓滴下,可观察到仪器b内的现象是________________,写出反应的离子方程式______________________________________。
(3)为证明氯气和苯发生的是取代而不是加成反应,该小组用装置F说明,则装置F置于________之间(填字母),F中小试管内CCl4的作用是___________________,还需使用的试剂是______________。
(4)已知D中加入5 mL苯,经过提纯后收集到氯苯3.0 g,则氯苯的产率为_________%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是
![]()

装置I 装置II
A. c极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
B. 当有0.1mol电子转移时,b极产生1.12L 气体Y(标准状况下)
C. 装置I与装置II的电解质溶液中,氢离子运动方向相反
D. RFC系统工作过程中只存在3种形式的能量转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaN、GaP、GaAs是人工合成的一系列新型半导体材料,其晶体结构均与金刚石相似。铜是重要的过渡元素,能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。回答下列问题:

(1)基态Ga原子价电子的轨道表达式为________________;
(2)熔点:GaN_____GaP(填“>”或“<”);
(3)第一电离能:As_____Se(填“>”或“<”);
(4)Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是______;
a.配位键 b.极性键 c.离子键 d.非极性键
(5)乙二胺分子中氮原子轨道的杂化类型为________,乙二胺和三甲胺[N(CH3)3]均属于胺。但乙二胺比三甲胺的沸点高很多,原因是___________;
(6)Cu的某种晶体晶胞为面心立方结构,晶胞边长为acm,铜原子的半径为rcm。该晶体中铜原子的堆积方式为_______型(填“A1”、“A2”或“A3”),该晶体密度为____g/cm3(用含a和NA的代数式表达),该晶体中铜原子的空间利用率为______(用含a和r的代数式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)判断下列物质在相应条件下能否电离,并说明理由。
①液态HCl:__________________,理由:_________________________________。
②熔融状态下的NaCl:__________________,理由:_________________________________。
③高温熔化后的单质铁:__________________,理由:_________________________________。
④固体KOH:__________________,理由:________________________________。
(2)写出下列物质在水溶液中的电离方程式。
HCl:____________________________________;
H2SO4:___________________________________________;
Ca(OH)2:_____________________________________________;
KOH:___________________________________________________;
NH4NO3:___________________________________________________;
KAl(SO4)2:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢气与溴蒸汽化合生成1mol溴化氢时放出的能量51kJ,1mol H-H、Br-Br和H-Br键断裂时需要吸收的能量分别是436kJ、a kJ和369kJ则a为( )
A. 404B. 260C. 230D. 200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与盐类的水解无关的是 ( )
A. 明矾净水B. 配制CuCl2溶液时加入适量盐酸
C. NaCl可用作防腐剂和调味剂D. 泡沫灭火器的灭火原理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com