
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.00 | |
| (2) | 0.0960 | 0.300 | 0.500 | |
| (3) | 0.300 | 0.0400 | 1.44 |
| 2.002 |
| 0.062×0.4 |
| 0.50002 |
| 0.0962×0.3 |
| 1.442 |
| 0.32×0.04 |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、0.lmolN2和0.3molH2在一定条件下充分反应,转移电子的数目为0.6NA |
| B、将含0.1mol FeCl3的溶液滴加到沸水中,水解生成胶体粒子数目为0.lNA |
| C、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| D、1L0.1mol?L-1 NaHCO3溶液中含有的阴离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
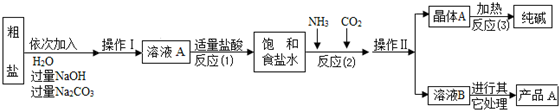
| 选择的装置 (填编号) |
实验现象 | 实验结论 |
| 样品不含晶体A |

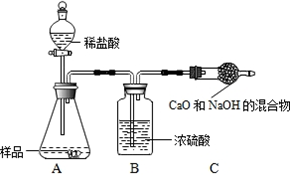
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:
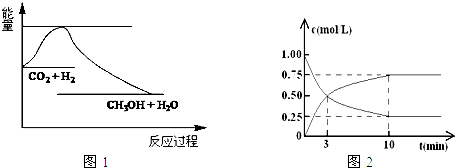
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前者大于后者 |
| B、前者小于后者 |
| C、前者等于后者 |
| D、无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com