
用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
| A.CS2是V形分子 | B.SnBr2键角大于120° |
| C.BF3是三角锥形分子 | D.NH4+键角等于109.5° |
科目:高中化学 来源: 题型:实验题
某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是________________________________________________;
②反应最剧烈的烧杯是_______(填字母);
③写出b烧杯里发生反应的离子方程式______ _____ __。
(2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了下图装置以验证碳、氮、硅元素的非金属性强弱。
乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。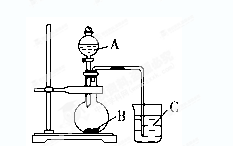
①写出所选用物质的化学式:A、________; B、________;C、________。
②写出烧瓶中发生反应的化学方程式:
___________________________________________________________。
③写出烧杯中发生反应的化学方程式:
___________________________________________________________。
④碳、氮、硅元素的非金属性强弱顺序为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
同学对“CO2是共价化合物和NH4Cl是离子化合物”有下列四点感悟,其中不正确的是
| A.离子化合物中可能含共价键 | B.共价化合物中一定不含离子键 |
| C.离子化合物中不一定含金属元素 | D.离子化合物中一定不含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.CHCl3是正四面体形 |
| B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形 |
| C.二氧化碳中碳原子为sp杂化,为直线形分子 |
D.NH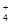 是三角锥形 是三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验测得BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,以下判断正确的是( )
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.BeCl2中Be采取sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,不正确的是( )
| A.双原子分子中的共价键,一定是非极性键 |
| B.非极性键也可能存在于离子化合物中 |
| C.分子间作用力,又叫范德华力,它比化学键要弱得多 |
| D.共价化合物在液态时不能导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com