
【题目】计算后填空:
(1)在标准状况下,448 mL某气体的质量为0.64 g,这种气体的相对分子质量为________。
(2)某氯化铁与氯化钠的混合液,已知c(Fe3+)=0.2 mol·L-1,c(Cl-)=1 mol·L-1。则c(Na+)为_____________。
(3)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(4)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为___________mol·L-1。
(5)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
(6)如图所示, 分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为_________________。
分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为_________________。
【答案】 32 0.4 mol·L-1 24 ![]() 6.4 mol 0.2 mol 7∶2或4∶5
6.4 mol 0.2 mol 7∶2或4∶5
【解析】(1)标准状况下,448 mL气体的物质的量为![]() =0.02 mol,该气体的摩尔质量为
=0.02 mol,该气体的摩尔质量为![]() =32 g·mol-1。
=32 g·mol-1。
(2)溶液呈电中性,根据电荷守恒3c(Fe3+)+c(Na+)=c(Cl-),则:3×0.2 mol·L-1+c(Na+)=1 mol·L-1,解得c(Na+)=0.4 mol·L-1。
(3)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则19 g RCl2的物质的量为0.4 mol×![]() =0.2 mol,RCl2的摩尔质量为
=0.2 mol,RCl2的摩尔质量为![]() =95 g·mol-1,则RCl2的相对分子质量为95,所以R的相对原子质量为95-35.5×2=24。
=95 g·mol-1,则RCl2的相对分子质量为95,所以R的相对原子质量为95-35.5×2=24。
(4)V L Fe2(SO4)3溶液中含Fe3+ m g,含有铁离子的物质的量为![]() =
=![]() mol,溶液中含有硫酸根离子的物质的量为
mol,溶液中含有硫酸根离子的物质的量为![]() mol×
mol×![]() =
=![]() mol,则溶液中SO
mol,则溶液中SO![]() 的物质的量浓度为
的物质的量浓度为![]() =
=![]() mol·L-1。
mol·L-1。
(5)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,该培养液中含有钾离子的总物质的量为1.6 mol+2.4 mol×2=6.4 mol,根据钾离子守恒,需要氯化钾的物质的量为6.4 mol;需要配制的溶液中含有氯离子的物质的量为5 mol+1.6 mol=6.6 mol,其中6.4 mol氯化钾中提供了6.4 mol氯离子,则还需要氯化铵的物质的量为6.6 mol-6.4 mol=0.2 mol。
(6)令空气的物质的量为1 mol,反应前,左右两室的体积之比为1∶3,反应前右室的物质的量为3 mol,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1 mol,发生反应2H2+O2![]() 2H2O,设H2、O2的物质的量分别为x mol、y mol,
2H2O,设H2、O2的物质的量分别为x mol、y mol,
若氢气过量,则:x-2y=1,x+y=3,解得x∶y=7∶2,
若氧气过量,则:y-0.5x=1,x+y=3,解得x∶y=4∶5。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,22.4 L NO与11.2 L O2混合后气体的体积约为22.4 L
B. 1 L 0.2 mol·L-1 Al2(SO4)3溶液中的离子总数为NA
C. 标准状况下,22.4 L H2O所含原子个数大于3NA
D. 含4 mol HCl的浓盐酸跟足量MnO2加热反应,可制得Cl2的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NO2溶于水时生成硝酸,故NO2是酸性氧化物
B. Fe(NO)2溶液中滴加盐酸溶液颜色有明显变化
C. 溴蒸汽和NO2都为红棕色气体,用湿润的淀粉-KI试纸可以鉴别
D. NO、CO在空气可以稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 同温同压下,相同体积的不同物质,其质量—定不相等
B. 任何条件下,等体积的甲烷和氮气所含的分子数—定相等
C. 1L一氧化碳气体一定比1L氧气的质量小
D. —氧化碳和氧气的混合气体,若平均相对分子质量为29,则一氧化碳气体和氧气的体积比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四支试管中分別盛有固体NaBr、NaCl、Na2SO3、Cu,分别向这四支试管中加入适量浓硫酸,部分现象如图所示:
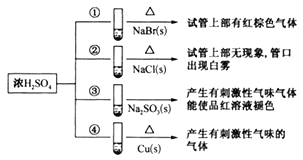
下列判断正确的是( )
A. 反应①和②的现象说明还原性:Br->Cl-
B. 浓硫酸与NaCl不反应,白雾是浓硫酸吸水所致
C. 反应③现象说明氧化性:浓硫酸>Na2SO3
D. 反应④的现象除产生刺激性气味的气体外,溶液中还析出蓝色晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于配合物的是( )
A. [Cu(H2O)4]SO4·H2O B. [Ag(NH3)2]OH
C. KAl(SO4)2·12H2O D. Na[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,已知稀HNO3有强氧化性,下列说法不正确的是

A. SO42-、SO32-至少含有一种
B. 沉淀B的化学式为BaCO3
C. 肯定存在的阴离子有CO32-、HCO3-、Cl-
D. 肯定没有的离子是Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com