
【题目】下列四支试管中分別盛有固体NaBr、NaCl、Na2SO3、Cu,分别向这四支试管中加入适量浓硫酸,部分现象如图所示:
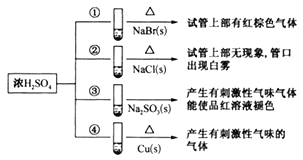
下列判断正确的是( )
A. 反应①和②的现象说明还原性:Br->Cl-
B. 浓硫酸与NaCl不反应,白雾是浓硫酸吸水所致
C. 反应③现象说明氧化性:浓硫酸>Na2SO3
D. 反应④的现象除产生刺激性气味的气体外,溶液中还析出蓝色晶体
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列叙述正确的是
A. 0.1 mol丙烯酸中含有双键的数目为0.1NA
B. 常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA
C. 一定条件下定容容器中充入3molH2(g)和1 mol N2(g)发生反应:H2(g)+ N2(g)![]() 2NH3(g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA
2NH3(g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA
D. 在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水,煤和石油燃烧的废气中也含有颗粒状的铬。
(1)某兴趣小组拟定以下流程,对含Cr3+、Fe2+等离子的废水进行无害化处理。

请回答下列问题:
①写出加入双氧水后发生反应的离子方程式:_____________________________。
②过滤操作需要的玻璃仪器有________________________________________。
③活性炭的作用是__________________________________________________。
(2)工业含铬废水中铬常以Cr2O![]() 形式存在,可按下列流程来除去废水中的铬。
形式存在,可按下列流程来除去废水中的铬。

①写出还原池中发生反应的离子方程式:________________________________。
②石灰水处理后生成的沉淀有______(用化学式表示)。
③现处理1×102L含铬(Ⅵ)39 mg·L-1的废水,需要绿矾________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算后填空:
(1)在标准状况下,448 mL某气体的质量为0.64 g,这种气体的相对分子质量为________。
(2)某氯化铁与氯化钠的混合液,已知c(Fe3+)=0.2 mol·L-1,c(Cl-)=1 mol·L-1。则c(Na+)为_____________。
(3)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(4)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为___________mol·L-1。
(5)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
(6)如图所示, 分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为_________________。
分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
选项 化合物 | A | B | C | D |
Y | H2O | FeCl3 | H2O | C |
W | HF | CuCl2 | Fe3O4 | Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2气体在一定条件下可与金属镁反应,干冰在一定条件下可以形成CO2气体,这两个变化过程中需要克服的作用分别是
A.共价键,共价键 B.共价键,分子间作用力
C.分子间作用力,共价键 D.分子间作用力,分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 1 mol Cl2中含有的原子数为NA
B. 标准状况下,a L氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
C. 标准状况下,22.4 L水中所含的分子数约为6.02×1023个
D. 从1 L0.5 mol·L-1NaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度为0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中可判定某酸为强电解质的现象是 ( )
A. 该酸加热至沸腾也不分解 B. 该酸可溶解Cu(OH)2
C. 该酸可跟石灰石反应放出CO2 D. 0.1 mol·L-1一元酸c(H+)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国医学家证实了3价铬离子(Cr3+)是构成葡萄糖耐量因子的重要组成部分,能够增强胰岛素的作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。
(1)Cr的价层电子排布图为__________________
(2)CS2分子的空间构型为__________,电子式为_____________,是__________ 分子(填“极性”或“非极性”);
(3)SCN-的电子式为_________________,它的等电子体中属于分子的有___________。
(4)四种分子:①CH4、②SO3、③H2O、④NH3,键角由大到小的排列顺序是______________________(填序号)。
(5)NH3分子可以与H+ 结合生成NH4+,这个过程发生改变的是(________)
a. 微粒的空间构型 b. N原子的杂化类型 c. H-N-H的键角 d. 微粒的电子数
(6)由碳元素形成的某种单质的片状和层状结构如图1所示,由碳元素形成的某种晶体的晶胞结构如图2所示,试回答:
①在图中,碳原子所形成的六元环数、C原子数、C-C键数之比为_____________;

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com