
【题目】下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
选项 化合物 | A | B | C | D |
Y | H2O | FeCl3 | H2O | C |
W | HF | CuCl2 | Fe3O4 | Si |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】关于电解NaCl水溶液,下列叙述正确的是 ( )
A. 电解时在阳极得到氯气,在阴极得到金属钠
B. 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C. 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D. 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡.
(1)醋酸是常见的弱酸.
① 醋酸在水溶液中的电离方程式为________________________________________________;
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号) 。
A.滴加少量浓盐酸 B.微热溶液 C.加水稀释 D.加入少量醋酸钠晶体
(2)用0.1 molL-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 molL-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

① 滴定醋酸的曲线是______________(填“I”或“Ⅱ”);
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____________________;
③ V1和V2的关系:V1 _____ V2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NO2溶于水时生成硝酸,故NO2是酸性氧化物
B. Fe(NO)2溶液中滴加盐酸溶液颜色有明显变化
C. 溴蒸汽和NO2都为红棕色气体,用湿润的淀粉-KI试纸可以鉴别
D. NO、CO在空气可以稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果ag某气体中含有的分子数为b,则cg该气体的物质的量是( )
A. bc/(aNA)mol B. ac/(bNA)mol C. ab/(cNA)mol D. b/(acNA)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四支试管中分別盛有固体NaBr、NaCl、Na2SO3、Cu,分别向这四支试管中加入适量浓硫酸,部分现象如图所示:
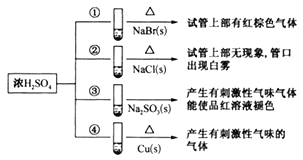
下列判断正确的是( )
A. 反应①和②的现象说明还原性:Br->Cl-
B. 浓硫酸与NaCl不反应,白雾是浓硫酸吸水所致
C. 反应③现象说明氧化性:浓硫酸>Na2SO3
D. 反应④的现象除产生刺激性气味的气体外,溶液中还析出蓝色晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加32 g。据此回答问题: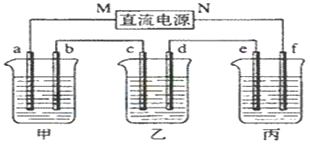
(1) 电源的N端为_________极;
(2) 电极b上发生的电极反应为____________________________________________;
(3) 电极f上生成的气体在标准状况下的体积_________________________________;
(4) 电解开始时,在甲烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是______________;
(5) 电解前后溶液的pH变化情况,(填增大、减小或不变)甲溶液___________;乙溶液_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为2.0 mol/L的CuSO4溶液。
①配制950 mL 2.0 mol/L的CuSO4溶液应称取胆矾的质量为____ ___g。
②某学生实际配制CuSO4溶液的浓度为1.8 mol/L,原因可能是__ ___。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时仰视刻度
(2)写出用上述方法制备CuCl的离子方程式_____ ____。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。其中“于70℃真空干燥”的目的是 ; _。(回答两点)
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是____ __ ___。
A. 氧化产物是HO2
B. HO2在碱中能稳定存在
C. HO2的电离方程式是HO2![]() H+ + O2-
H+ + O2-
D. 1mol Cu 参加反应有2mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下,Cu与浓硫酸会发生氧化还原反应,某学校化学学习小组成员在实验室中对该实验进行了探究。回答下列问题:
(1)写出Cu与浓硫酸反应生成SO2的化学方程式:______________________________________。
(2)气体发生装置选取_______(选填“甲、乙、丙”)。



(3)成员甲采用下列装置探究混合气体中是否含有H2:

装置 | 装置中的试剂 | 装置作用 | 实验现象 |
A | NaOH浓溶液 | ① | |
B | 品红溶液 | ② | |
C | ③ | 干燥作用 | |
D | CuO | ④ | |
E | ⑤ | ||
F | 碱石灰 | ⑥ |
①___________________;②_________________;③______________________;④____________;⑤________________;⑥_________________________。
(4)某次实验结束后,Cu与浓硫酸反应后,Cu剩余,且铜片上附着黑色粉末物质。该小组成员乙查阅资料如下:
CuS为黑色粉末,难溶于水,在空气中加热至220℃以上时可迅速被氧气氧化生成黑色的CuO和SO2。
①该同学刮下铜片上的黑色物质,加入到试管中,然后加蒸馏水,振荡,静置后发现溶液为浅蓝色,由此确定该黑色粉末中含有___________。
②请你帮助该同学设计实验验证该黑色物质为CuS____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com