
| A. | H2CO3?2H++CO32- | B. | NaHSO4=Na ++HSO4- | ||
| C. | NaHCO3=Na++H++CO32- | D. | NH4Cl=NH4++Cl- |
分析 A.碳酸为二元弱酸分步电离,以第一步为主;
B.亚硫酸氢根离子为强酸的酸式根离子,水溶液中需要拆成氢离子、硫酸根离子;
C.碳酸氢根离子为弱酸的酸式根离子,不能拆;
D.氯化铵为强电解质,完全电离.
解答 解:A.碳酸为二元弱酸分步电离,以第一步为主,电离方程式:H2CO3?H++HCO3-,故A错误;
B.硫酸氢钠为强电解质,完全电离,电离方程式:NaHSO4=Na ++H++SO42-,故B错误;
C.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3=Na++H++CO32-,故C错误;
D.氯化铵为强电解质,电离方程式:NH4Cl=NH4++Cl-,故D正确;
故选:D.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 200mL 2mol/L MgCl2溶液 | B. | 150mL 5mol/L KClO3溶液 | ||
| C. | 标准状况下,13.44L的HCl气体 | D. | 29.25gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |
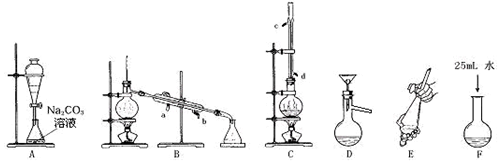
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量5.3 g Na2CO3固体溶于480 mL水配制成溶液 | |
| B. | 称量5.3 g Na2CO3固体溶于水配制成0.5 L溶液 | |
| C. | 称量5.3 g Na2CO3•10H2O晶体溶于水配制成0.5 L溶液 | |
| D. | 称量5.3 g Na2CO3•10H2O晶体溶于0.5 L水配制成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
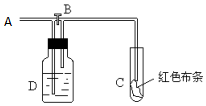 如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )| A. | abc | B. | bcd | C. | abd | D. | abcd |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
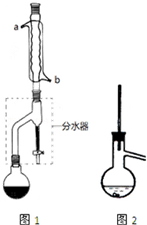 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com