
【题目】利用生活中或实验室中的常用物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)装置连接好实验仪器,这时可以听见耳机发出“嚓嚓嚓…”的声音。其原因是在原电池中化学能转化为电能,在耳机中__又转化为声波这种能量。
(3)在该原电池中,Fe在__极发生了__反应,H+在__极发生了_反应。
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
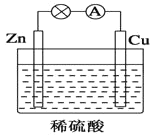
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu-→Zn
⑥正极反应式:Cu+2e-═Cu2+,发生氧化反应
A.①②③B.②④
C.②④⑥D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,密闭可变容器中发生可逆反应N2+3H2![]() 2NH3能说明反应已达到平衡状态的是
2NH3能说明反应已达到平衡状态的是
A.以上三种物质的浓度相等B.压强恒定
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法不正确的是
A. 1,3-二甲苯也称间二甲苯
B. 乙烷和新戊烷分子中所含甲基数之比为1∶2
C. 苯与溴水不能发生加成反应,所以两者混合后无明显现象
D. ![]() 和C4H10的二氯代物的数目不同(不含立体异构)
和C4H10的二氯代物的数目不同(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是
、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是

A. 25 ℃时,HClO2的电离平衡常数的数值Ka=10-6
B. 使用该漂白剂的最佳pH为3.0
C. 25 ℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO![]() )+2c(OH-)
)+2c(OH-)
D. 该温度下的NaClO2溶液中c(Na+)>c(ClO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH均为2的盐酸、硫酸、醋酸三瓶溶液
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是________________________(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是___________________________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是____________________________。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应过程中放出H2的速率依次为a1、a2、a3,则其关系是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸,反应式为:
主反应:
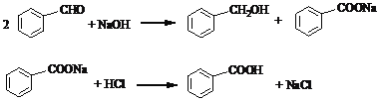
副反应:
![]()
主要物料的物理常数如下表:
名称 | 分子量 | 性状 | 相对密度 (g·cm-3) | 沸点 (℃) | 溶解度 | ||
水 | 乙醚 | ||||||
苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 | |
苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g | |
苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 | |
乙醚 | 74 | 无色液体。 | 0.71 | 35 | 不溶 | -- | |
实验步骤:
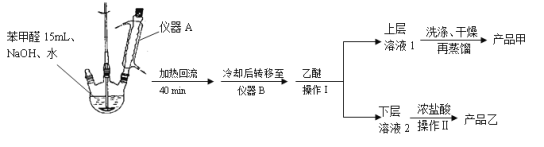
(1)仪器A的作用是_______________。
(2)蒸馏操作时温度应该控制在___________左右。获得产品乙时进行的操作Ⅱ的名称是__________________。
(3)①上层溶液1中除乙醚外主要有机杂质是____________、_____________。
洗涤时先后用到了饱和NaHSO3 溶液、10%的NaHCO3溶液和水。
②洗涤操作在______________中进行。
a.烧杯 b.布氏漏斗 c.烧瓶 d.分液漏斗
③加入10%的NaHCO3溶液至___________________(填现象)时说明杂质已被除尽。
(4)若产品甲的质量为5.40 g,则产品甲的产率是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A.所有的硅酸盐都难溶于水,可用带玻璃塞的玻璃瓶盛放
B.SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应
C.SiO2与纯碱在高温条件下反应生成CO2,说明硅酸的酸性比碳酸强
D.石灰石是工业制备普通玻璃和水泥的共同原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol·L-1HCl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL 2 mol·L-1NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程_____________。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因___________。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是_________。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是____________。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是___________。
③乙同学这样配制混合溶液的理由是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com