
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中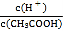 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】为解决能源危机,有人提出用CaCO3制取C2H2作燃料。具体反应为:
① CaCO3(s)![]() CaO(s)+CO2(g)
CaO(s)+CO2(g)
② CaO(s)+3C(s)![]() CaC2(s)+CO(g)
CaC2(s)+CO(g)
③ CaC2(s)+H2O(l)![]() CaO(s)+C2H2(g)
CaO(s)+C2H2(g)
(1)制备1mol C2H2(g)需一定量的C(s),这些炭完全燃烧可放热__________kJ
(2)若1mol C2H2完全燃烧可放出热量1298kJ,则将C2H2(g)作为燃料是否合算?说明理由__________。
(3)为什么反应①和②需要高温,反应③只需常温__________(已知有关物质的△Hf(298k)/kJ·mol-1为:CaC2(s):—60,CO2(g):—393,H2O(l):—285,C2H2(g):227,CaO(s):—635,CaCO3(s):—1207,CO(g):—111)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. N2(g)![]() NH3(g)
NH3(g)![]() NH4Cl(aq)
NH4Cl(aq)
B. Fe(s)![]() FeCl2(s)
FeCl2(s)![]() Fe(OH)2(s)
Fe(OH)2(s)
C. MgO(s)![]() MgSO4(aq)
MgSO4(aq)![]() Mg(s)
Mg(s)
D. S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组将废铁屑(含硫化亚铁等杂质)和稀硫酸加入锥形瓶中,加热,充分反应,冷却后加入氨水,制得硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O],装置如下图(夹持仪器略去)。下列说法或操作错误的是
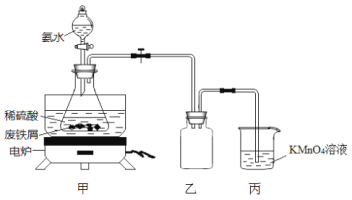
A.乙装置是安全瓶
B.将氨水滴入时,先缓慢打开活塞,再打开玻璃塞
C.KMnO4溶液的作用是吸收H2S等尾气,防止污染空气
D.锥形瓶中发生中和反应的离子方程式:NH3·H2O+H+=NH4++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
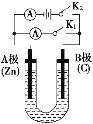
(1)断开K2,闭合K1,若所盛溶液为CuSO4溶液,则A极为________极,B极的电极反应式为_________________________________________。若所盛溶液为KCl溶液,则B极的电极反应式为__________________________________。
(2)断开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可以观察到的现象是________,Na+移向________(填“A”或“B”)极。
②B电极上的电极反应式为______________________________________,总反应的化学方程式是_________________________________________。
③反应一段时间后断开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,溶液的pH约为________。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制![]() 的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
A.①②B.③C.③④D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒物质的量浓度关系正确的是( )
A. 0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(![]() )>c(
)>c(![]() )>c(H+)>c(Fe2+)
)>c(H+)>c(Fe2+)
B. 将100mL 0.1mol·L-1Na2CO3溶液逐滴滴加到100mL 0.1mol·L-1盐酸中:c(Na+)>c(C1-)>c(![]() )>c(
)>c(![]() )
)
C. pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 0.1mol·L-1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下浓度均为![]() 的下列5种溶液:
的下列5种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
![]() 这5种溶液pH由大到小的顺序是________________,其中由水电离的
这5种溶液pH由大到小的顺序是________________,其中由水电离的![]() 浓度最小的是______。
浓度最小的是______。![]() 填序号
填序号![]()
![]() 中各离子浓度由大到小的顺序是________________________________________________________,
中各离子浓度由大到小的顺序是________________________________________________________,![]() 的水解平衡常数
的水解平衡常数![]() _________________。
_________________。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
![]() 向
向![]() 中通入少量氨气,此时
中通入少量氨气,此时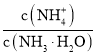 的值__________
的值__________![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 若将
若将![]() 和
和![]() 混合后溶液恰好呈中性,则混合前
混合后溶液恰好呈中性,则混合前![]() 的体积______
的体积______![]() 的体积
的体积![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 。
。
![]() 将
将![]() 的溶液分别蒸干并灼烧,最终可得原溶质的是____________
的溶液分别蒸干并灼烧,最终可得原溶质的是____________![]() 填序号
填序号![]() 。
。
![]() 一定量的稀
一定量的稀![]() 溶液与足量的Zn反应,为减缓产生的
溶液与足量的Zn反应,为减缓产生的![]() 速率但又不影响
速率但又不影响![]() 的总量,可采取的措施是______
的总量,可采取的措施是______![]() 填字母
填字母![]() 。
。
A.加![]() 固体
固体![]() 加
加![]() 固体
固体![]() 加
加![]() 溶液
溶液![]() 加氨水
加氨水![]() 加
加![]() 溶液
溶液
![]() 常温下,向
常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为_____
的溶液为_____![]()
![]() 已知常温下
已知常温下![]() 。
。
![]() 等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中
等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸等体积混合后溶液呈__________________性,溶液中
的醋酸等体积混合后溶液呈__________________性,溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() 常温下,用
常温下,用![]() 溶液滴定
溶液滴定![]() 某一元酸HA溶液所得滴定曲线如图.
某一元酸HA溶液所得滴定曲线如图.
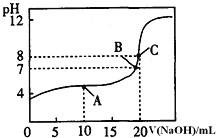
![]() A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
![]() 点的离子浓度大小关系是 ________________________________ .
点的离子浓度大小关系是 ________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁是中学化学常见的金属。请回答下列问题:
(1)常温下,铝和铁放入浓HNO3中会发生_______;
A.都反应产生氢气B.只有铝反应产生氢气
C.只有铁反应产生氢气D.都钝化
(2)常温下,铝粉和铁粉分别放入氢氧化钠溶液中,能反应产生氢气的是_______,
(3)铝热反应的化学方程式:2Al+Fe2O3![]() 2Fe+Al2O3,其氧化剂是_________。
2Fe+Al2O3,其氧化剂是_________。
A.AlB.FeC.Fe2O3D.Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com