
����Ŀ����ͼ��ʾ��U�ι���ʢ��100mL����Һ����Ҫ��ش��������⣺
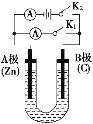
��1���Ͽ�K2���պ�K1������ʢ��ҺΪCuSO4��Һ����A��Ϊ________����B���ĵ缫��ӦʽΪ_________________________________________������ʢ��ҺΪKCl��Һ����B���ĵ缫��ӦʽΪ__________________________________��
��2���Ͽ�K1���պ�K2������ʢ��ҺΪ���з�̪��NaCl��Һ����
��A�缫�������Թ۲쵽��������________��Na������________(�A����B��)����
��B�缫�ϵĵ缫��ӦʽΪ______________________________________���ܷ�Ӧ�Ļ�ѧ����ʽ��_________________________________________��
�۷�Ӧһ��ʱ���Ͽ�K2����������Һ������仯��������ܽ⣬B��������������(��״��)Ϊ11.2mL������Һ��ֻ�ϣ���Һ��pHԼΪ________����Ҫʹ�������Һ�ָ���ԭ״̬������U�ι��ڼ����ͨ��һ������________��
���𰸡��� Cu2����2e��=Cu O2��2H2O��4e��=4OH�� ��Һ��� A 2Cl����2e��=Cl2�� 2NaCl��2H2O![]() 2NaOH��Cl2����H2�� 12 HCl
2NaOH��Cl2����H2�� 12 HCl
��������
(1)����ʢ��ҺΪCuSO4��Һ����K2���ϲ�K1����װ����ԭ��أ��ϻ��õĽ����������������Ϸ���������Ӧ���ϲ����õĽ�����ķǽ����������������Ϸ�����ԭ��Ӧ������ʢ��ҺΪKCl��Һ����B���������õ��ӷ�����ԭ��Ӧ��
(2)��װ���ǵ��أ�������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ�����ݵ缫���̼������������ӵ�Ũ�ȣ��ټ���pH��
(1)����ʢ��ҺΪCuSO4��Һ���Ͽ�K2���պ�K1ʱ����װ����ԭ��أ�п��������̼��������������ͭ���ӵõ�������ͭ������������Ӧ���缫��ӦʽΪCu2����2e��=Cu����ʢ��ҺΪKCl��Һʱ����������ʴ������(B��)�ĵ缫��ӦʽΪO2��2H2O��4e��=4OH����
(2)�Ͽ�K1���պ�K2������ʢ��ҺΪ���з�̪��NaCl��Һ��
����װ���ǵ��أ�̼����������п�������������ʱ��п���������ӷŵ�����������ͬʱ�缫�������ɵ����������ӵ�����Һ�ʼ��ԣ������̪��Һ���죻��Һ�е�Na���������ƶ�������A�缫�ƶ���
�����ʱ������B�������ӷŵ�����������2Cl����2e��=Cl2���������������ӷŵ�����������ͬʱ��Һ�������������ƣ����Ե���ܷ�ӦʽΪ2NaCl��2H2O![]() 2NaOH��H2����Cl2����
2NaOH��H2����Cl2����
��������֪��B������(��״��)11.2mL Cl2������0.001mol NaOH����c(OH��)=0.01mol/L��c(H��)=![]() mol/L=10-12mol/L����pH=12�������ݳ�������ֱ���H2��Cl2����Ҫʹ�������Һ�ָ���ԭ״̬������U�ι���ͨ��һ������HCl���塣
mol/L=10-12mol/L����pH=12�������ݳ�������ֱ���H2��Cl2����Ҫʹ�������Һ�ָ���ԭ״̬������U�ι���ͨ��һ������HCl���塣


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ��pH��Ϊa��NaOH��Һ�Ͱ�ˮ�ֱ��ˮϡ��100����pH�ֱ��Ϊb��c����a��b��c�Ĵ�С��ϵΪb>c>a
B. ������0.1 molL-1 KHA��Һ��pH=3�������Һ��C(A2- )<c(H2A)
C. ����ʱ M(OH)2(s)![]() M2+(aq)+2OH-(aq) Ksp=a���� c(M2��)=b molL-1 ʱ����Һ��pHΪ14 +
M2+(aq)+2OH-(aq) Ksp=a���� c(M2��)=b molL-1 ʱ����Һ��pHΪ14 +![]() 1g
1g![]()
D. 0.1 molL-1 Na2CO3��Һ��c(OH-)=c(H��)+c(HCO3-)+c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ����Ŀǰ���ǶԻ�������������Դ���������ӣ��о�NO2��NO��CO��SO2�ȴ�����Ⱦ��ת��Ϊ�ܲ������ѭ�������ʣ��Խ��������й�������Ҫ���塣
(1)�������ͨ����ѭ�����CO���ۺϴ�����ԭ��Ϊ
a��2CO(g)+SO2(g)![]() S(l)+2CO2(g) ��H1= �� 37.4kJ��mol��1
S(l)+2CO2(g) ��H1= �� 37.4kJ��mol��1
b��S(l)+2H2O(g)![]() 2H2(g)+SO2(g) ��H2=��45.4 kJ��mol��1
2H2(g)+SO2(g) ��H2=��45.4 kJ��mol��1
��CO��ˮ������ȫ��Ӧ����H2��CO2���Ȼ�ѧ����ʽΪ__________________________________��
(2)CO����һ��������ת��ΪCH3OH����֪����2L�ܱ�������ͨ��2 molCO��4molH2�����ʺϵĴ�����T1�¶��£�������ӦCO(g)+2H2(g)![]() CH3OH(g) ��H<0��10minʱ�ﵽƽ��״̬��10min��ı��¶�ΪT2��20minʱ�ﵽƽ��״̬����Ӧ�����в������ݼ�����
CH3OH(g) ��H<0��10minʱ�ﵽƽ��״̬��10min��ı��¶�ΪT2��20minʱ�ﵽƽ��״̬����Ӧ�����в������ݼ�����
��Ӧʱ�� | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
��ǰ10min�ڵ�ƽ����Ӧ����v(CO)= _______����20minʱ���¶�T2�£��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ________________��
����30minʱ�����¶ȣ���ѧƽ�ⳣ��ֵ_______(�����������С����������)��
����T1�¶��£���������Ӧ���ʺ����COƽ��ת���ʵĴ�ʩ��_____________(�����ִ�ʩ����)
���ں��º����£����п����ж�CO(g)+2H2(g)![]() CH3OH(g)��Ӧ�ﵽƽ��״̬��________(�����)��
CH3OH(g)��Ӧ�ﵽƽ��״̬��________(�����)��
a��2v��(H2)=v��(CH3OH) b�������������ʵ������ٱ仯
c����λʱ������1 mol CO����ͬʱ����2molH2 d����������ƽ����Է�����������
(3)��֪��Ӧ2NO(g)+O2(g)![]() 2NO2������Ӧ����v��=k1Cm(NO)Cn(O2)������k1Ϊ���ʳ�������ͨ���±�ʵ�����ݼ���k1��m��n��
2NO2������Ӧ����v��=k1Cm(NO)Cn(O2)������k1Ϊ���ʳ�������ͨ���±�ʵ�����ݼ���k1��m��n��
��� | ��ʼŨ��/mol��L-1 | ��ʼ����/ mol��L-1��S-1 | |
NO | O2 | ||
1 | 0.02 | 0.0125 | 7.98��10-3 |
2 | 0.02 | 0.0250 | 15.96��10-3 |
3 | 0.04 | 0.0125 | 31.92��10-3 |
��k1=____�� m =_____�� n =_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25Cʱ,0.1mol/L��3����Һ������ڰ�ˮ��CH3COONa��Һ������˵����,����ȷ����
A. 3����Һ��pH��С���Ǣ�
B. 3����Һ��ˮ�ĵ���̶������Ǣ�
C. ����ڵ������Ϻ���Һ������
D. ����۵������Ϻ�c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֳּ���̽�����������Ʊ�ʵ��絼��(�絼��Խ���ʾ��������Խǿ)�ı仯��Ũ�Ⱦ�Ϊ0.5 mol��L��1 ���������ƺͰ�ˮ�ֱ�ζ�0.01 mol��L��1��������Һ���絼�ʱ仯������ͼ��ʾ������˵���������
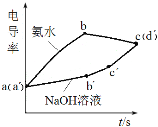
A.a(a)����ҺpH��7
B.bc�ε絼���½�����Ϊ������Al(OH)3����
C.ab�κ�bc��ʹ�ü�������ԼΪ3:1
D.b����Һ��c(H+)��2c(SO42��)+c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ���ǣ� ��
A.��0.1mol��L-1CH3COOH��Һ�м�������ˮ����Һ��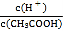 ��С
��С
B.��CH3COONa��Һ��20��������30�棬��Һ��![]() ����
����
C.�������м��백ˮ�����ԣ���Һ��![]() ��1
��1
D.��AgCl��AgBr�ı�����Һ�м�������AgNO3����Һ��![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ɫ��������ˮ����������ҵ��������������Ϊԭ�ϣ�ͨ������(FeOOH)�Ʊ�������أ��ɽ��������ɱ��Ҳ�Ʒ�����š��������̣�
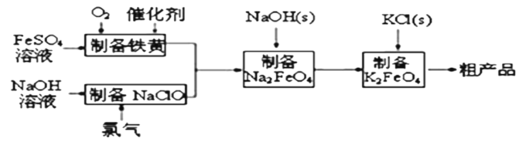
�ش��������⣺
(1)��֪�������£�Ksp[Fe(OH)3]=4.0��10��38��������صľ�ˮ�������ˮ��pH�йأ�����ҺpH=2ʱ����ˮ��c(Fe3+)=_______________molL��1
(2)�Ʊ����Ƶ����ӷ���ʽΪ_______________��ʵ���÷�Ӧ��Һ��pH���¶ȶ����Ʋ��ʵ�Ӱ����ͼ��ʾ����Ӧ�¶���ѡ��_________��
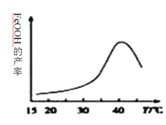
(3)�ٸ���������ˮ��Һ�������ֺ������塣25��ʱ�����ǵ����ʵ���������pH�ı仯��ͼ��ʾ��
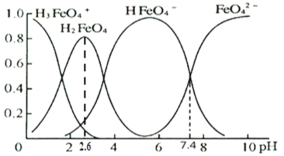
pH=2.6ʱ����Һ����Ҫ��������Ũ�ȵĴ�С��ϵΪ________��
����֪H3FeO4+���볣���ֱ�Ϊ��K1=2.51��10��2��K2=4.16��10��4��K3=5.01��10��8����pH=4ʱ����Һ��![]() =________��
=________��
(4)��ҵ�ϻ�����ͨ�����ŨNaOH��Һ�Ʊ�Na2FeO4���乤��ԭ����ͼ��ʾ�������ĵ缫��ӦʽΪ__________�����п�ѭ��ʹ�õ�����____________��
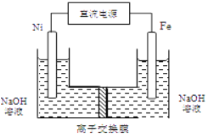
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ij�¶�(t ��)ʱ�����0.01 mol��L��1��NaOH��Һ��pH��11������¶���ˮ��Kw��______���ڴ��¶��£���pH��a��NaOH��ҺVa L��pH��b��H2SO4��ҺVb L��ϣ������û��ҺΪ���ԣ���a��b��12����Va��Vb��________��
(2)25 ��ʱ��0.1 mol��L��1��HA��Һ��![]() ��1010����ش��������⣺
��1010����ش��������⣺
��HA��________(�ǿ����ʡ���������ʡ�)��
���ڼ�ˮϡ��HA��Һ�Ĺ����У�����ˮ�������Ӷ��������__________(����ĸ)��
a.c(HA) b.![]() c.c(H��)��c(OH��)�ij˻� d.c(OH��)
c.c(H��)��c(OH��)�ij˻� d.c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ɳ�����չ������أ���Դ�������������Լ��ճ�����ȶ��벻����ѧ��
��1�����ȷ�Ӧ�ڹ�ҵ�����е���Ҫ��;֮һ��_________________���û�ѧ����ʽ��ʾ�����е�ԭ��________________________________________����һ����������Ʒ��Ϊ�������γ����ܵ���������Ĥ���������ã����Ǹ�����Ĥ�ױ�����ƻ�������������������������Һ���ã���Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��2����������Ư�ס�����ʱ������Ư�ס��������õ�������____________(д��ѧʽ)��ȱ����ƶѪ����Ӧ����FeԪ�أ�ͨ����������������ʽ��ҩ������������û������ҩЧ���������������Ƴ�ҩƬʱ�������һ����������£�������µ�������_______________��
��3��þ���Ż�ʱ��������Һ̬CO2����������ԭ����_________�����û�ѧ����ʽ��ʾ����
��4����������AlN���������¡�������������Ժõ��������ʣ����㷺Ӧ���ڵ��ӹ�ҵ���մɹ�ҵ��������һ�������£���������ͨ�����·�Ӧ�ϳɣ�Al2O3+N2+3C=2AlN+3CO��
���ڻ�ѧ����ʽ�ϱ���÷�Ӧ�е���ת�Ƶķ������Ŀ��_________
���ڸ÷�Ӧ�У���������________________ ������������_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com