
����Ŀ��(1)ij�¶�(t ��)ʱ�����0.01 mol��L��1��NaOH��Һ��pH��11������¶���ˮ��Kw��______���ڴ��¶��£���pH��a��NaOH��ҺVa L��pH��b��H2SO4��ҺVb L��ϣ������û��ҺΪ���ԣ���a��b��12����Va��Vb��________��
(2)25 ��ʱ��0.1 mol��L��1��HA��Һ��![]() ��1010����ش��������⣺
��1010����ش��������⣺
��HA��________(�ǿ����ʡ���������ʡ�)��
���ڼ�ˮϡ��HA��Һ�Ĺ����У�����ˮ�������Ӷ��������__________(����ĸ)��
a.c(HA) b.![]() c.c(H��)��c(OH��)�ij˻� d.c(OH��)
c.c(H��)��c(OH��)�ij˻� d.c(OH��)
���𰸡�1��10��1310��1�������bd
��������
��1��0.01 mol��L��1��NaOH��Һ������������Ũ��Ϊ0.01 mol��L��1����Һ��pHΪ11����Һ��������Ũ��Ϊ10��11 mol��L��1�����¶���ˮ�����ӻ�Kw��0.01��10��11=1��10��13 ���ڴ��¶���, ��pH��a��NaOH��ҺVa L��pH��b��H2SO4��ҺVb L��ϣ������û��ҺΪ���ԣ�˵�����������Ӻ�������ǡ�÷�Ӧ, Va��10a-13= Vb��10-b����Va��Vb��1013-a-b��1������a��b��12������ó�Va��Vb=10��1����ˣ�������ȷ����: 1��10��13 ��10��1��
(2)��25 ��ʱ��0.1 mol��L��1��HA��Һ��c(H��)/c(OH-)=1010, ����Kw��c(H��) ��c(OH-)=10-14��֪��c2(H��)= 1��10��4 ��c(H��)= 1��10��2 mol��L��1��˵��HA�����������������������ȷ�������������
��a. ����HA![]() H++ A-ƽ�⣬�ڼ�ˮϡ��HA��Һ�Ĺ����У�ƽ�����ƣ�n(H+)��n(A-)����, n(HA) ��С����V���, c(HA) ��С,��a������
H++ A-ƽ�⣬�ڼ�ˮϡ��HA��Һ�Ĺ����У�ƽ�����ƣ�n(H+)��n(A-)����, n(HA) ��С����V���, c(HA) ��С,��a������
b. ����HA![]() H++ A-ƽ�⣬�ڼ�ˮϡ��HA��Һ�Ĺ�����, ƽ�����ƣ�n(H+)��n(A-)����, n(HA) ��С��V���, ��ͬһ��Һ��V��ͬ��c(H+)/c(HA)= n(H+)/n(HA), ����ˮ�������ӱ�ֵ����, ��b��ȷ��
H++ A-ƽ�⣬�ڼ�ˮϡ��HA��Һ�Ĺ�����, ƽ�����ƣ�n(H+)��n(A-)����, n(HA) ��С��V���, ��ͬһ��Һ��V��ͬ��c(H+)/c(HA)= n(H+)/n(HA), ����ˮ�������ӱ�ֵ����, ��b��ȷ��
c. ˮ�����ӻ�����ֻ���¶�Ӱ����c(H+)��c(OH��)�ij˻���������c������
d. ����HA��ˮϡ��,��Һ���Լ���,������Ũ�ȼ�С,�����¶Ȳ�����KwҲ�ͱ��ֲ��䣬��������������Ũ������,��d��ȷ��
��ˣ�������ȷ����: b d��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�NaHC03��Na2C03�����ʣ����������в���ȷ����
A. Na2C03��NaHC03��ĩ��ͬŨ�����ᷴӦʱ��Na2C03�����ǿ�����������ᷴӦ�ų������ٶȿ�
B. �����ʵ�������������ͬŨ�����ᷴӦ��Na2C03���������������� NaHC03������
C. ��Na2C03������Һ��ͨ�˹���CO2����NaHC03�ᾧ����
D. Na2C03��NaHC03��Һ�ֱ��BaCl2��Һ��Ӧ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪4NH3��5O2=4NO��6H2O������Ӧ���ʷֱ�����(NH3)����(O2)����(NO)����(H2O)��ʾ������ȷ�Ĺ�ϵ��
A.4��(NH3)��5��(O2)B.5��(O2)��6��(H2O)
C.2��(NH3)��3��(H2O)D.4��(O2)��5��(NO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĿ��淴Ӧ��mA(g)��nB(g)![]() pC(g)��qD(g)��������C�����������ѹǿp1��p2��ʱ��t1��t2�Ĺ�ϵ��ͼ��ʾ�������й�ϵ��ȷ����(����)
pC(g)��qD(g)��������C�����������ѹǿp1��p2��ʱ��t1��t2�Ĺ�ϵ��ͼ��ʾ�������й�ϵ��ȷ����(����)
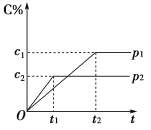
��p1>p2����p1<p2����m��n>p��q����m��n��p��q����m��n<p��q
A. �٢� B. �ڢ� C. �ڢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĸ���ͬ�����У���ͬ�����½��з�ӦN2+3H22NH3����������ͬʱ���ڲⶨ�Ľ�����жϸ÷�Ӧ�����������ǣ� ��
A. ����NH3��=0.5molL��1min��1
B. ����H2��=0.3molL��1min��1
C. ����N2��=0.2molL��1min��1
D. ����H2��=0.01molL��1s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��������ʵĻ���������һ��ϵͳ���Ĺ��̣������ɿɷ�Ϊ�ĸ����裮�������о��������ʵ�һ�����ĵ�һ����
A. Ԥ���������� B. �۲����ʵ��������
C. ����ʵ��۲� D. �����йصĽ��ͺͽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NO2��NO��CO��NO2- �ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
��1����֪����NO2 + CO ![]() CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����������ֱ�Ϊ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��N2(g)+O2(g) ![]() 2NO(g) ��H��+179.5 kJ/mol K2
2NO(g) ��H��+179.5 kJ/mol K2
��2NO(g) +O2(g)![]() 2NO2(g) ��H��-112.3 kJ/mol K3
2NO2(g) ��H��-112.3 kJ/mol K3
��д��NO��CO��Ӧ��������Ⱦ��������Ȼ�ѧ����ʽ____________________________�Լ����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=____________����K1��K2��K3��ʾ��
��2����Ⱦ������NO2��CO��һ�������µķ�ӦΪ��2NO2+4CO![]() 4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����
4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����![]() ����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
�����¶��£�ijʱ�̲��NO2��CO��CO2��N2��Ũ�ȷֱ�Ϊamol/L��0.4mol/L��0.1mol/L��1mol/L��Ҫʹ��Ӧ���淴Ӧ������У�a��ȡֵ��Χ________________��
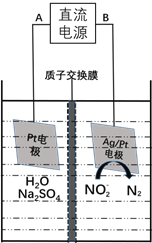
��3���绯ѧ����NO2-��ԭ������ͼ��
����Դ�ĸ�����____________����A��B��������ӦʽΪ________________��
������������ת����6mol���ӣ���Ĥ������Һ�������仯��![]() Ϊ_____g��
Ϊ_____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ��������Һ���ܹ�������������ǣ�������
A.Al3+��NH4+��NO3����Cl��B.Br����Fe2+��Fe3+��SO42��
C.Na+��SO32����K+��NO3��D.K+��Na+��I ����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��������ڼ����ͪ(CH3COCH3)�ͱ�ȩ����
A. ���ϣȼ�շ� B. ���ڷ� C. ���� D. 1H-NMR��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com