
【题目】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)铝热反应在工业生产中的重要用途之一是_________________;用化学方程式表示出其中的原理________________________________________(举一例)。铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若将氧化铝与氢氧化钠溶液作用,反应的化学方程式为____________________________________。
(2)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是____________(写化学式)。缺铁性贫血患者应补充Fe元素,通常以硫酸亚铁的形式给药,而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是_______________。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是_________。(用化学方程式表示)。
(4)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO。
①在化学方程式上标出该反应中电子转移的方向和数目。_________
②在该反应中,氧化剂是________________ ,氧化产物是_______________。
【答案】焊接钢轨(或冶炼难熔金属 ) 2Al+Fe2O3==== Al2O3+2Fe Al2O3+2NaOH==2NaAlO2+H2O HClO 保护FeSO4不被空气中的氧气氧化 2Mg+CO2![]() 2MgO+C
2MgO+C 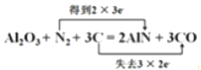 N2 CO
N2 CO
【解析】
试题(1)铝热法是一种利用铝的还原性获得高熔点金属单质的方法;如氧化铁与铝粉反应生成氧化铝和铁;氧化铝是两性氧化物与氢氧化钠溶液反应生成偏铝酸钠。(2)次氯酸具有漂白、消毒作用;亚铁离子易被氧化为铁离子;(3)镁能在二氧化碳中燃烧;
(4)氮化铝中氮元素化合价由0变为-3,碳元素化合价由0变为+2,据此回答;
解析:(1)铝热法是一种利用铝的还原性获得高熔点金属单质的方法,铝热反应在工业生产中的重要用途之一是冶炼难熔金属;如氧化铁与铝粉反应生成氧化铝和铁,反应方程式是2Al+Fe2O3==== Al2O3+2Fe;氧化铝是两性氧化物与氢氧化钠溶液反应生成偏铝酸钠,反应方程式是Al2O3+2NaOH==2NaAlO2+H2O。(2)次氯酸具有漂白、消毒作用;亚铁离子易被氧化为铁离子,所以层糖衣的作用是保护FeSO4不被空气中的氧气氧化;(3)镁能在二氧化碳中燃烧,方程式是2Mg+CO2![]() 2MgO+C ;
2MgO+C ;
(4)氮化铝中氮元素化合价由0变为-3,碳元素化合价由0变为+2;
①该反应中电子转移的方向和数目 ;
;
②在该反应中,氮气中氮元素化合价由0变为-3,氧化剂是N2 ,碳元素化合价由0变为+2,氧化产物是CO
点睛 :所含元素化合价升高的反应物是还原剂,化合价升高所得的产物是氧化产物;所含元素化合价降低的反应物是氧化剂,化合价降低所得的产物是还原产物。


科目:高中化学 来源: 题型:
【题目】如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
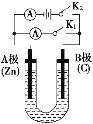
(1)断开K2,闭合K1,若所盛溶液为CuSO4溶液,则A极为________极,B极的电极反应式为_________________________________________。若所盛溶液为KCl溶液,则B极的电极反应式为__________________________________。
(2)断开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可以观察到的现象是________,Na+移向________(填“A”或“B”)极。
②B电极上的电极反应式为______________________________________,总反应的化学方程式是_________________________________________。
③反应一段时间后断开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,溶液的pH约为________。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
括号内为杂质 | 除杂试剂 | 操作 | |
1 | 乙烷(乙烯) | _____ | _____ |
2 | 乙酸乙酯(乙酸) | _____ | _____ |
3 | 苯(苯酚) | _____ | _____ |
4 | 乙醇(水) | _____ | _____ |
(2)以五倍子为原料可制得A,A结构简式如图所示,回答下列问题:
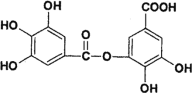
①A的分子式为_______________。
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为____________。
③写出A与过量NaOH溶液反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银是一种在工业、生活上有广泛用途的金属。
已知:①金属在水中存在如下溶解平衡过程:M![]() Mx+ + xe-,
Mx+ + xe-,
氢气在水溶液中也存在如下平衡过程:H2![]() 2H++ 2e-
2H++ 2e-
②Ag2S 的Ksp=6.7×10-50; AgCl的Ksp=1.6×10-10
据此回答下列有关问题:
(1)银质餐具可杀菌消毒,原因是_________________(用适当的方程式和文字表述说明);金属银与氢硫酸可反应生成黑色固体和无色气体,写出该反应的化学方程式_______________
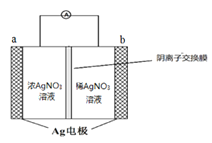
(2)金属银与硝酸银溶液组成电池示意图如右,a电极的反应为________________,NO3-从电池________侧溶液向电池_______侧溶液移动 (填“左”或“右”)。
(3)硝酸银见光或受热易分解为Ag、NO2、O2,反应中生成NO2、O2的 物质的量之比为___________,将混合气体通过水吸收后,剩余气体为________________
(4)已知:Ag+(aq) + 2NH3H2O(aq)![]() [Ag(NH3)2]+(aq) + 2H2O K=1.6×107,写出AgCl溶于氨水的离子方程式________________________;计算该反应的平衡常数K=___________。在氯化银溶于氨水后的溶液中滴加稀硝酸,会再产生白色氯化银沉淀,滴加硝酸至刚好沉淀完全,取上层清液测其pH,发现呈酸性,主要原因是_______________(用离子方程式表示)。
[Ag(NH3)2]+(aq) + 2H2O K=1.6×107,写出AgCl溶于氨水的离子方程式________________________;计算该反应的平衡常数K=___________。在氯化银溶于氨水后的溶液中滴加稀硝酸,会再产生白色氯化银沉淀,滴加硝酸至刚好沉淀完全,取上层清液测其pH,发现呈酸性,主要原因是_______________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁是中学化学常见的金属。请回答下列问题:
(1)常温下,铝和铁放入浓HNO3中会发生_______;
A.都反应产生氢气B.只有铝反应产生氢气
C.只有铁反应产生氢气D.都钝化
(2)常温下,铝粉和铁粉分别放入氢氧化钠溶液中,能反应产生氢气的是_______,
(3)铝热反应的化学方程式:2Al+Fe2O3![]() 2Fe+Al2O3,其氧化剂是_________。
2Fe+Al2O3,其氧化剂是_________。
A.AlB.FeC.Fe2O3D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一——芥子醇结构简式如图所示。下列有关芥子醇的说法正确的是( )
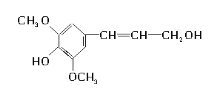
A.芥子醇分子中含9种不同化学环境的H原子
B.芥子醇分子中所有碳原子不可能在同一平面上
C.芥子醇属于芳香族化合物,分子式是C11H12O4
D.芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:

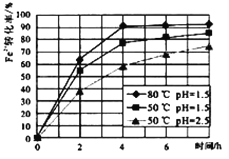
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:__________(写一种)。
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是__________________________。根据如图有关数据,你认为工业上氧化操作时应采取的条件是__________________________。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___________________范围。操作Ⅰ的名称是_________________。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是__________________、________________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是( )。
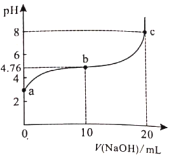
A.HA是弱酸B.b点溶液中:![]()
C.b、c之间一定存在![]() 的点D.a、b、c三点中,c点水的电离程度最大
的点D.a、b、c三点中,c点水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com