
ЎѕМвДїЎїТшКЗТ»ЦЦФЪ№¤ТµЎўЙъ»оЙПУР№г·єУГНѕµДЅрКфЎЈ
ТСЦЄЈєўЩЅрКфФЪЛ®ЦРґжФЪИзПВИЬЅвЖЅєв№эіМЈєM![]() Mx+ + xe-Ј¬
Mx+ + xe-Ј¬
ЗвЖшФЪЛ®ИЬТєЦРТІґжФЪИзПВЖЅєв№эіМЈєH2![]() 2H++ 2e-
2H++ 2e-
ўЪAg2S µДKsp=6.7ЎБ10-50Ј» AgClµДKsp=1.6ЎБ10-10
ѕЭґЛ»ШґрПВБРУР№ШОКМвЈє
ЈЁ1Ј©ТшЦКІНѕЯїЙЙ±ѕъПы¶ѕЈ¬ФТтКЗ_________________ЈЁУГККµ±µД·ЅіМКЅєНОДЧЦ±нКцЛµГчЈ©Ј»ЅрКфТшУлЗвБтЛбїЙ·ґУ¦ЙъіЙєЪЙ«№ММеєНОЮЙ«ЖшМеЈ¬РґіцёГ·ґУ¦µД»ЇС§·ЅіМКЅ_______________
ЈЁ2Ј©ЅрКфТшУлПхЛбТшИЬТєЧйіЙµзіШКѕТвНјИзУТЈ¬aµзј«µД·ґУ¦ОЄ________________Ј¬NO3-ґУµзіШ________ІаИЬТєПтµзіШ_______ІаИЬТєТЖ¶Ї ЈЁМоЎ°ЧуЎ±»тЎ°УТЎ±Ј©ЎЈ
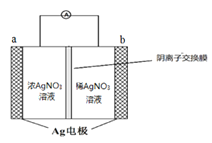
ЈЁ3Ј©ПхЛбТшјы№в»тКЬИИТЧ·ЦЅвОЄAgЎўNO2ЎўO2Ј¬·ґУ¦ЦРЙъіЙNO2ЎўO2µД ОпЦКµДБїЦ®±ИОЄ___________Ј¬Ѕ«»мєПЖшМеНЁ№эЛ®ОьКХєуЈ¬КЈУаЖшМеОЄ________________
ЈЁ4Ј©ТСЦЄЈєAg+(aq) + 2NH3H2O(aq)![]() [Ag(NH3)2]+(aq) + 2H2O K=1.6ЎБ107Ј¬РґіцAgClИЬУЪ°±Л®µДАлЧУ·ЅіМКЅ________________________Ј»јЖЛгёГ·ґУ¦µДЖЅєвіЈКэK=___________ЎЈФЪВИ»ЇТшИЬУЪ°±Л®єуµДИЬТєЦРµОјУПЎПхЛбЈ¬»бФЩІъЙъ°ЧЙ«ВИ»ЇТшіБµнЈ¬µОјУПхЛбЦБёХєГіБµнНкИ«Ј¬ИЎЙПІгЗеТєІвЖдpHЈ¬·ўПЦіКЛбРФЈ¬ЦчТЄФТтКЗ_______________ЈЁУГАлЧУ·ЅіМКЅ±нКѕЈ©ЎЈ
[Ag(NH3)2]+(aq) + 2H2O K=1.6ЎБ107Ј¬РґіцAgClИЬУЪ°±Л®µДАлЧУ·ЅіМКЅ________________________Ј»јЖЛгёГ·ґУ¦µДЖЅєвіЈКэK=___________ЎЈФЪВИ»ЇТшИЬУЪ°±Л®єуµДИЬТєЦРµОјУПЎПхЛбЈ¬»бФЩІъЙъ°ЧЙ«ВИ»ЇТшіБµнЈ¬µОјУПхЛбЦБёХєГіБµнНкИ«Ј¬ИЎЙПІгЗеТєІвЖдpHЈ¬·ўПЦіКЛбРФЈ¬ЦчТЄФТтКЗ_______________ЈЁУГАлЧУ·ЅіМКЅ±нКѕЈ©ЎЈ
Ўѕґр°ёЎїAg ![]() Ag++ e-Ј¬AgИЬЅвКН·ЕµДAg+КЗЦШЅрКфСфАлЧУЈ¬К№ПёѕъМеДЪµ°°ЧЦК±дРФЈ¬ґУ¶шЙ±ѕъПы¶ѕ 2Ag + H2S = Ag2S + H2Ўь Ag++ e-= Ag Чу УТ 2:1 СхЖш AgCl + 2NH3H2O(aq)
Ag++ e-Ј¬AgИЬЅвКН·ЕµДAg+КЗЦШЅрКфСфАлЧУЈ¬К№ПёѕъМеДЪµ°°ЧЦК±дРФЈ¬ґУ¶шЙ±ѕъПы¶ѕ 2Ag + H2S = Ag2S + H2Ўь Ag++ e-= Ag Чу УТ 2:1 СхЖш AgCl + 2NH3H2O(aq)![]() [Ag(NH3)2]+(aq) + Cl-+ 2H2O K=2.56ЎБ10-3 NH4++ H2O
[Ag(NH3)2]+(aq) + Cl-+ 2H2O K=2.56ЎБ10-3 NH4++ H2O![]() NH3H2O + H+
NH3H2O + H+
ЎѕЅвОцЎї
ЈЁ1Ј©ёщѕЭМвёшРЕПўЈєM![]() Mx+ + xe-Ј¬AgК§ИҐµзЧУЙъіЙµДAg+КЗЦШЅрКфАлЧУЈ¬їЙТФК№µ°°ЧЦК±дРФЈ¬ґУ¶шїЙТФЙ±ѕъПы¶ѕЈ»ЅрКфТшУлЗвБтЛбїЙ·ґУ¦ЙъіЙєЪЙ«№ММеAg2SєНОЮЙ«ЖшМеH2Ј»
Mx+ + xe-Ј¬AgК§ИҐµзЧУЙъіЙµДAg+КЗЦШЅрКфАлЧУЈ¬їЙТФК№µ°°ЧЦК±дРФЈ¬ґУ¶шїЙТФЙ±ѕъПы¶ѕЈ»ЅрКфТшУлЗвБтЛбїЙ·ґУ¦ЙъіЙєЪЙ«№ММеAg2SєНОЮЙ«ЖшМеH2Ј»
ЈЁ2Ј©ЅрКфТшУлПхЛбТшИЬТєЧйіЙµДЕЁІоµзіШЈ¬aµзј«КЗХэј«Ј¬Ag+µГµЅµзЧУЙъіЙAgЈ¬bµзј«КЗёєј«Ј¬AgК§ИҐµзЧУЙъіЙAg+Ј¬ТхАлЧУТЖПтёєј«Ј»
ЈЁ3Ј©ПхЛбТшјы№в»тКЬИИТЧ·ЦЅвОЄAgЎўNO2ЎўO2Ј¬ёщѕЭФЧУКШєгїЙИ·¶Ё·ґУ¦ЦРЙъіЙNO2ЎўO2µДОпЦКµДБїЦ®±ИЈ»ёщѕЭ![]() Ј¬їЙјЖЛгЅ«ОпЦКµДБїЦ®±ИОЄ2:1µДNO2єНO2»мєПЖшМеНЁ№эЛ®ОьКХєуЈ¬КЈУаЖшМеµДіЙ·ЦЈ»
Ј¬їЙјЖЛгЅ«ОпЦКµДБїЦ®±ИОЄ2:1µДNO2єНO2»мєПЖшМеНЁ№эЛ®ОьКХєуЈ¬КЈУаЖшМеµДіЙ·ЦЈ»
ЈЁ4Ј©ёщѕЭAg+(aq) + 2NH3H2O(aq)![]() [Ag(NH3)2]+(aq) + 2H2OЈ¬РґіцAgClИЬУЪ°±Л®µДАлЧУ·ЅіМКЅЈ»ёщѕЭёшіцµД·ґУ¦µДKєНAgClµДKspЈ¬їЙјЖЛгAgClИЬУЪ°±Л®µД·ґУ¦µДЖЅєвіЈКэЎЈФЪВИ»ЇТшИЬУЪ°±Л®єуµДИЬТєЦРµОјУПЎПхЛб·ґУ¦єуµДЙПІгЗеТєЦРє¬NH4+Ј¬Л®ЅвіКЛбРФЎЈ
[Ag(NH3)2]+(aq) + 2H2OЈ¬РґіцAgClИЬУЪ°±Л®µДАлЧУ·ЅіМКЅЈ»ёщѕЭёшіцµД·ґУ¦µДKєНAgClµДKspЈ¬їЙјЖЛгAgClИЬУЪ°±Л®µД·ґУ¦µДЖЅєвіЈКэЎЈФЪВИ»ЇТшИЬУЪ°±Л®єуµДИЬТєЦРµОјУПЎПхЛб·ґУ¦єуµДЙПІгЗеТєЦРє¬NH4+Ј¬Л®ЅвіКЛбРФЎЈ
ЈЁ1Ј©AgФЪЛ®ЦРґжФЪИзПВИЬЅвЖЅєв№эіМЈєAg![]() Ag++ e-Ј¬AgИЬЅвКН·ЕµДAg+КЗЦШЅрКфСфАлЧУЈ¬К№ПёѕъМеДЪµ°°ЧЦК±дРФЈ¬ґУ¶шЙ±ѕъПы¶ѕЈ»ЅрКфТшУлЗвБтЛбїЙ·ґУ¦ЙъіЙЗвЖшєНБт»ЇТшЈ¬·ЅіМКЅОЄ2Ag + H2S = Ag2S + H2ЎьЈ»
Ag++ e-Ј¬AgИЬЅвКН·ЕµДAg+КЗЦШЅрКфСфАлЧУЈ¬К№ПёѕъМеДЪµ°°ЧЦК±дРФЈ¬ґУ¶шЙ±ѕъПы¶ѕЈ»ЅрКфТшУлЗвБтЛбїЙ·ґУ¦ЙъіЙЗвЖшєНБт»ЇТшЈ¬·ЅіМКЅОЄ2Ag + H2S = Ag2S + H2ЎьЈ»
ЈЁ2Ј©NO3-ґУёЯЕЁ¶ИЗшУтТЖ¶ЇµЅµНЕЁ¶ИЗшУтЈ¬ЛщТФNO3-ґУЧуІаТЖ¶ЇµЅУТІаЈ»aОЄХэј«Ј¬bОЄёєј«Ј»aј«·ґУ¦ОЄAg++ e-= AgЈ»
ЈЁ3Ј©ПхЛбТшјы№в»тКЬИИТЧ·ЦЅвОЄAgЎўNO2ЎўO2Ј¬µЄФЧУЈєСхФЧУ=1:3Ј¬ЙиNO2ЎўO2µДОпЦКµДБї·Ц±рx molЎўy mol,ОЄёщѕЭФЄЛШКШєгЈ¬![]() Ј¬NO2ЎўO2µДОпЦКµДБїЦ®±ИОЄ2:1Ј»ёщѕЭ
Ј¬NO2ЎўO2µДОпЦКµДБїЦ®±ИОЄ2:1Ј»ёщѕЭ![]() Ј¬Ѕ«»мєПЖшМеНЁ№эЛ®ОьКХєуЈ¬КЈУаЖшМеОЄСхЖшЈ»
Ј¬Ѕ«»мєПЖшМеНЁ№эЛ®ОьКХєуЈ¬КЈУаЖшМеОЄСхЖшЈ»
ЈЁ4Ј©AgClИЬУЪ°±Л®µДАлЧУ·ЅіМКЅAgCl + 2NH3H2O(aq)![]() [Ag(NH3)2]+(aq) + Cl-+ 2H2OЈ¬
[Ag(NH3)2]+(aq) + Cl-+ 2H2OЈ¬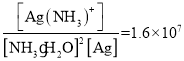 Ј¬AgClµДKsp=1.6ЎБ10-10Ј¬јґ
Ј¬AgClµДKsp=1.6ЎБ10-10Ј¬јґ![]() Ј»ЛщТФ
Ј»ЛщТФ Ј»ФЪВИ»ЇТшИЬУЪ°±Л®єуµДИЬТєЦРµОјУПЎПхЛб,·ўЙъNH3H2O+HNO3= NH4NO3+ H2OЈ¬»бК№AgCl + 2NH3H2O(aq)
Ј»ФЪВИ»ЇТшИЬУЪ°±Л®єуµДИЬТєЦРµОјУПЎПхЛб,·ўЙъNH3H2O+HNO3= NH4NO3+ H2OЈ¬»бК№AgCl + 2NH3H2O(aq)![]() [Ag(NH3)2]+(aq) + Cl-+ 2H2O·ґУ¦µДЖЅєвДжПтТЖ¶ЇЈ¬ІъЙъ°ЧЙ«ВИ»ЇТшіБµнЈ¬µОјУПхЛбЦБёХєГіБµнНкИ«Ј¬ИЬТєЦРµДИЬЦКОЄNH4NO3Ј¬п§ёщАлЧУЛ®ЅвЈ¬NH4++ H2O
[Ag(NH3)2]+(aq) + Cl-+ 2H2O·ґУ¦µДЖЅєвДжПтТЖ¶ЇЈ¬ІъЙъ°ЧЙ«ВИ»ЇТшіБµнЈ¬µОјУПхЛбЦБёХєГіБµнНкИ«Ј¬ИЬТєЦРµДИЬЦКОЄNH4NO3Ј¬п§ёщАлЧУЛ®ЅвЈ¬NH4++ H2O![]() NH3H2O + H+Ј¬ЛщТФИЬТєіКЛбРФЎЈ
NH3H2O + H+Ј¬ЛщТФИЬТєіКЛбРФЎЈ


 їЄРДїмАЦјЩЖЪЧчТµКојЩЧчТµОч°Ііц°жЙзПµБРґр°ё
їЄРДїмАЦјЩЖЪЧчТµКојЩЧчТµОч°Ііц°жЙзПµБРґр°ё ГыМвСµБ·ПµБРґр°ё
ГыМвСµБ·ПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїАыУГКЦіЦјјКхМЅѕїЗвСх»ЇВБЦЖ±ёКµСйµзµјВК(µзµјВКФЅґу±нКѕµјµзДЬБ¦ФЅЗї)µД±д»ЇЈ¬ЕЁ¶ИѕщОЄ0.5 molЎ¤LЈ1 µДЗвСх»ЇДЖєН°±Л®·Ц±рµО¶Ё0.01 molЎ¤LЈ1БтЛбВБИЬТєЈ¬µзµјВК±д»ЇЗъПЯИзНјЛщКѕЈ¬ПВБРЛµ·ЁґнОуµДКЗ
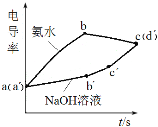
A.a(a)µгИЬТєpHЈј7
B.bc¶ОµзµјВКПВЅµКЗТтОЄЙъіЙБЛAl(OH)3іБµн
C.ab¶ОєНbc¶ОК№УГјоµДМе»э±ИФјОЄ3:1
D.bµгИЬТєЈєc(H+)Јј2c(SO42Ј)+c(OHЈ)
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЪОВ¶ИІ»±дЎўєгИЭµДИЭЖчЦРЅшРР·ґУ¦2HI![]() H2+I2(Хэ·ґУ¦ОЄОьИИ·ґУ¦)Ј¬·ґУ¦ОпµДЕЁ¶ИУЙ0.1 mol/LЅµµЅ0.06 mol/LЈ¬РиТЄ20 sЈ¬ДЗГґУЙ0.06 mol/LЅµµЅ0.036 mol/LЛщРиК±јдОЄ( )
H2+I2(Хэ·ґУ¦ОЄОьИИ·ґУ¦)Ј¬·ґУ¦ОпµДЕЁ¶ИУЙ0.1 mol/LЅµµЅ0.06 mol/LЈ¬РиТЄ20 sЈ¬ДЗГґУЙ0.06 mol/LЅµµЅ0.036 mol/LЛщРиК±јдОЄ( )
A.µИУЪ10 sB.µИУЪ12 sC.ґуУЪ12 sD.РЎУЪ12 s
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї№¤ТµЙПіЈУГ»№ФіБµн·Ёґ¦Анє¬ёх·ПЛ®(Cr2O72ЈєНCrO42Ј)Ј¬ЖдБчіМОЄ
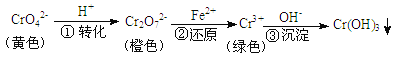
ІЅЦиўЫЙъіЙµДCr(OH)3ФЪИЬТєЦРґжФЪТФПВіБµнИЬЅвЖЅєвЈєCr(OH)3(s)![]() Cr3+(aq)+3OH-(aq) KspЈЅc(Cr3+)c3(OH-)ЈЅ10-32Ј¬ПВБРУР№ШЛµ·ЁХэИ·µДКЗ
Cr3+(aq)+3OH-(aq) KspЈЅc(Cr3+)c3(OH-)ЈЅ10-32Ј¬ПВБРУР№ШЛµ·ЁХэИ·µДКЗ
A.ІЅЦиўЩЦРµ±v(CrO42-)ЈЅ2v(Cr2O72-)К±Ј¬ЛµГч·ґУ¦Јє2CrO42-+2H+ ![]() Cr2O72- +H2OґпµЅЖЅєвЧґМ¬
Cr2O72- +H2OґпµЅЖЅєвЧґМ¬
B.ИфПтK2Cr2O7ИЬТєЦРјУNaOHЕЁИЬТєЈ¬ИЬТєїЙУЙ»ЖЙ«±діИЙ«
C.ІЅЦиўЪЦРЈ¬ИфТЄ»№Ф1 mol Cr2O72- АлЧУЈ¬РиТЄ12 molµДFe2+
D.ІЅЦиўЫЦРЈ¬µ±Ѕ«ИЬТєµДpH µчЅЪЦБ5 К±Ј¬їЙИПОЄ·ПЛ®ЦРµДёхФЄЛШТС»щ±ѕіэѕЎ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї°ґТЄЗуКйРґПВБР·ґУ¦µД·ЅіМКЅЈє
(1)NO2 ИЬУЪЛ®µД»ЇС§·ґУ¦·ЅіМКЅЈє_____ЎЈ
(2)КµСйКТЦЖИЎ°±ЖшµД»ЇС§·ґУ¦Јє_____ЎЈ
(3)ЧгБїµД SO2 ЖшМеНЁИлµЅ NaOH ЦРµДАлЧУ·ґУ¦·ЅіМКЅЈє______________ЎЈ
(4)ємИИµДМјєНЕЁПхЛбµД»ЇС§·ґУ¦·ЅіМКЅЈє_____ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї»ЇС§УлИЛАаЙз»бїЙіЦРш·ўХ№ГЬЗРПа№ШЈ¬ДЬФґЎў»·ѕіЎўІДБПТФј°ИХіЈЙъ»оµИ¶јАлІ»їЄ»ЇС§ЎЈ
ЈЁ1Ј©ВБИИ·ґУ¦ФЪ№¤ТµЙъІъЦРµДЦШТЄУГНѕЦ®Т»КЗ_________________Ј»УГ»ЇС§·ЅіМКЅ±нКѕіцЖдЦРµДФАн________________________________________ЈЁѕЩТ»АэЈ©ЎЈВБЦЖЖ·ТтОЄ±нГжТЧРОіЙЦВГЬµДСх»ЇВБ±ЎД¤¶шѕѕГДНУГЈ¬µ«КЗёГСх»ЇД¤ТЧ±»ЛбјоЖЖ»µЈ¬ИфЅ«Сх»ЇВБУлЗвСх»ЇДЖИЬТєЧчУГЈ¬·ґУ¦µД»ЇС§·ЅіМКЅОЄ____________________________________ЎЈ
ЈЁ2Ј©ВИЖшУГУЪЖЇ°ЧЎўПы¶ѕК±Ј¬ДЬЖрЖЇ°ЧЎўПы¶ѕЧчУГµДОпЦККЗ____________(Рґ»ЇС§КЅ)ЎЈИ±МъРФЖ¶СЄ»јХЯУ¦І№ідFeФЄЛШЈ¬НЁіЈТФБтЛбСЗМъµДРОКЅёшТ©Ј¬¶шБтЛбМъФтГ»УРХвЦЦТ©Р§ЎЈµ±УГБтЛбСЗМъЦЖіЙТ©Ж¬К±Нв±н°ьУРТ»ІгМШКвµДМЗТВЈ¬ХвІгМЗТВµДЧчУГКЗ_______________ЎЈ
ЈЁ3Ј©ГѕґшЧЕ»рК±Ј¬І»ДЬУГТєМ¬CO2Гр»рјБАґГр»рµДФТтКЗ_________ЎЈЈЁУГ»ЇС§·ЅіМКЅ±нКѕЈ©ЎЈ
ЈЁ4Ј©µЄ»ЇВБЈЁAlNЈ©ѕЯУРДНёЯОВЎўї№іе»чЎўµјИИРФєГµИУЕБјРФЦКЈ¬±»№г·єУ¦УГУЪµзЧУ№¤ТµЎўМХґЙ№¤ТµµИБмУтЎЈФЪТ»¶ЁМхјюПВЈ¬µЄ»ЇВБїЙНЁ№эИзПВ·ґУ¦єПіЙЈєAl2O3+N2+3C=2AlN+3COЎЈ
ўЩФЪ»ЇС§·ЅіМКЅЙП±кіцёГ·ґУ¦ЦРµзЧУЧЄТЖµД·ЅПтєНКэДїЎЈ_________
ўЪФЪёГ·ґУ¦ЦРЈ¬Сх»ЇјБКЗ________________ Ј¬Сх»ЇІъОпКЗ_______________ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТ»¶ЁМхјюПВМъїЙТФєН CO2 ·ўЙъ·ґУ¦ЈєFe(s)Ј«CO2(g)FeO(s)Ј«CO(g)ЎЈТ»¶ЁОВ¶ИПВЈ¬ПтДіГЬ±ХИЭЖчЦРјУИлЧгБїМъ·ЫІўідИлТ»¶ЁБїµД CO2 ЖшМеЈ¬·ґУ¦№эіМЦР CO2 ЖшМеєН CO ЖшМеµДЕЁ¶ИУлК±јдµД№ШПµИзНјЛщКѕЈє

(1)t1 К±Ј¬ХэЎўДж·ґУ¦ЛЩВКµДґуРЎ№ШПµОЄ v Хэ_____v Дж(МоЎ°ЈѕЎ±Ў°ЈјЎ±»тЎ°ЈЅЎ±)ЎЈ
(2)4 min ДЪЈ¬CO µДЖЅѕщ·ґУ¦ЛЩВК v(CO)ЈЅ_____ЎЈ
(3)ПВБРМхјюµДёД±дДЬјхВэЖд·ґУ¦ЛЩВКµДКЗ_____(МоРтєЕЈ¬ПВН¬)ЎЈ
ўЩЅµµНОВ¶И
ўЪјхЙЩМъ·ЫµДЦКБї
ўЫ±ЈіЦС№ЗїІ»±дЈ¬ідИл He К№ИЭЖчµДМе»эФцґу
ўЬ±ЈіЦИЭ»эІ»±дЈ¬ідИл He К№МеПµС№ЗїФцґу
(4)ПВБРГиКцДЬЛµГчЙПКц·ґУ¦ТСґпЖЅєвЧґМ¬µДКЗ_____ЎЈ
ўЩv(CO2)ЈЅv(CO)
ўЪµҐО»К±јдДЪЙъіЙ n mol CO2 µДН¬К±ЙъіЙ n mol CO
ўЫИЭЖчЦРЖшМеС№ЗїІ»ЛжК±јд±д»Ї¶ш±д»Ї
ўЬИЭЖчЦРЖшМеµДЖЅѕщПа¶Ф·ЦЧУЦКБїІ»ЛжК±јд±д»Ї¶ш±д»Ї
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПтТ»¶ЁБїµДСОЛбЦРЦрµОјУИлNaAlO2ИЬТєЈ¬ЙъіЙіБµнAl(OH)3µДБїЛжNaAlO2јУИлБїµД±д»Ї№ШПµИзНјЛщКѕЎЈЙъіЙµДіБµн№эВЛіэИҐєуЈ¬ФтПВБРАлЧУЧйФЪ¶ФУ¦µДИЬТєЦРТ»¶ЁДЬґуБї№ІґжµДКЗ
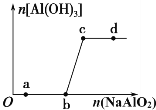
A. aµг¶ФУ¦µДИЬТєЦРЈєNa+ЎўK+ HCO3- ClЈ
B. bµг¶ФУ¦µДИЬТєЦРЈєNa+ЎўOHЈЎўSO42-ЎўClЈ
C. cµг¶ФУ¦µДИЬТєЦРЈєNa+ЎўK+ЎўAg+ЎўNO3-
D. dµг¶ФУ¦µДИЬТєЦРЈєNa+ЎўK+ЎўOHЈЎўClЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїСЗПххЈВИ(ClNO)їЙУЙNOУлCl2ФЪНЁіЈМхјюПВ·ґУ¦µГµЅЈ¬»ЇС§·ЅіМКЅОЄ2NO(g)Ј«Cl2(g)![]() 2ClNO(g)ЎЈ
2ClNO(g)ЎЈ
(1)ФЪТ»¶ЁОВ¶ИПВЈ¬ёГ·ґУ¦УЪТ»єгИЭГЬ±ХИЭЖчЦРґпµЅЖЅєвЈ¬јМРшНЁИлCl2Ј¬Дж·ґУ¦ЛЩВК________(МоЎ°ФцґуЎ±Ў°јхРЎЎ±»тЎ°І»±дЎ±)ЎЈ
(2)ТСЦЄјёЦЦ»ЇС§јьµДјьДЬКэѕЭИз±н(СЗПххЈВИµДЅб№№КЅОЄClЎЄN=O)Јє
»ЇС§јь | NO | ClЎЄCl | ClЎЄN | N=O |
јьДЬ/(kJЎ¤molЈ1) | 630 | 243 | a | 607 |
2NO(g)Ј«Cl2(g)![]() 2ClNO(g)ЎЎ¦¤HЈЅЈ111 kJЎ¤molЈ1Ј¬ФтaЈЅ________ЎЈ
2ClNO(g)ЎЎ¦¤HЈЅЈ111 kJЎ¤molЈ1Ј¬ФтaЈЅ________ЎЈ
(3)ФЪ1 LµДєгИЭГЬ±ХИЭЖчЦРідИл2 mol NO(g)єН1 mol Cl2(g)Ј¬ФЪІ»Н¬ОВ¶ИПВІвµГc(ClNO)УлК±јдµД№ШПµИзНјЈє
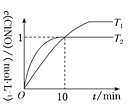
ўЩґУ·ґУ¦їЄКјµЅ10 minК±NOµДЖЅѕщ·ґУ¦ЛЩВКv(NO)ЈЅ________molЎ¤LЈ1Ў¤minЈ1ЎЈ
ўЪT2К±ёГ·ґУ¦µДЖЅєвіЈКэKЈЅ________ЎЈ
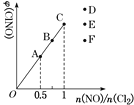
(4)Т»¶ЁМхјюПВФЪєгОВєгИЭµДГЬ±ХИЭЖчЦР°ґТ»¶Ё±ИАэідИлNO(g)єНCl2(g)Ј¬ЖЅєвК±ClNOµДМе»э·ЦКэЛжn(NO)/n(Cl2)µД±д»ЇНјПсИзНјЈ¬ФтAЎўBЎўCИэЧґМ¬ЦРЈ¬NOµДЧЄ»ЇВКЧоґуµДКЗ________µгЈ¬µ±n(NO)/n(Cl2)ЈЅ1.5К±Ј¬·ґУ¦ґпµЅЖЅєвЧґМ¬ClNOµДМе»э·ЦКэїЙДЬКЗDЎўEЎўFИэµгЦРµД________µгЎЈ
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com