
【题目】下列属于盐的是( )
A. NaHCO3 B. CaO C. NaOH D. H2SO4
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
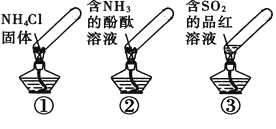
A. 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B. 加热时,②溶液褪色或红色变浅,冷却后又都变为红色
C. 加热时,③溶液褪色或红色变浅,冷却后又都变为红色
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)写出图中仪器a的名称:_______________。
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为_____________,发生和收集装置为____________(填字母)。
(3)实验室用石灰石和稀盐酸反应智取二氧化碳,其中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从F装置的______________端口(填“①”或“②”)通入,F中发生的化学反应方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2(g)+O2(g)![]() 2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是

A.甲中反应的平衡常数小于乙B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:a1>a2=a3D.容器中S03的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题:
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
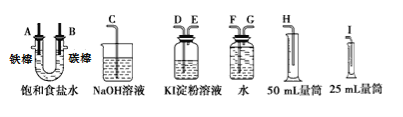
(1)A极发生的电极反应式是,B极发生的电极反应式是。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:A接、接;B接、接。
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为。
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8mL(标准状况)。此时溶液pH约为。(lg2=0.3,lg3=0.5,lg5=0.7)
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验。若甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C,列式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A. ![]() 的化学性质与
的化学性质与![]() 相同 B.
相同 B. ![]() 的原子序数为53
的原子序数为53
C. ![]() 的原子核外电子数为78 D.
的原子核外电子数为78 D. ![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)为白色粉末,微溶于水。常用作有机合成催化剂,并用于颜料、防腐等工业。实验室可采用亚硫酸钠还原氯化铜的方法制备氯化亚铜,主要流程如图所示:
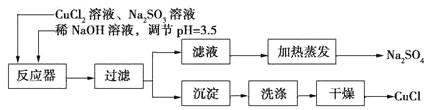
(1)上述方法制备氯化亚铜的化学方程式为_________________。
(2)下图是加热蒸发滤液,回收Na2SO4的装置。装置图中存在一处严重错误,该错误是_____________。

(3)洗涤产品氯化亚铜沉淀的试剂是____________,检验沉淀是否洗涤干净的方法是_______________。
(4)CuCl的盐酸溶液能吸收一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。
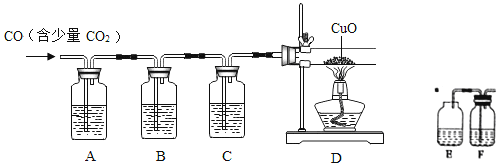
装置A中盛装的是饱和NaOH溶液,该装置的作用是______________,装置B盛有澄清的石灰水,其中装置B的作用是_____________,盛装CuCl的盐酸溶液的装置是__________(选填装置中提供的装置字母代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO![]() 、NO
、NO![]()
B.无色溶液中可能大量存在Al3+、NH![]() 、Cl-、S2-
、Cl-、S2-
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO![]()
D.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
①混合气体的平均摩尔质量是___________________。
②混合气体中所含碳原子的物质的量是_____________________。
③CO2和CO的体积之比是_______________________。
(2)标准状况下有①0.112 L水 ②0.5NA个HCl分子③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol He 所含原子个数从大到小的顺序为__________________。
(3)将质量分数为a%,物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是_______________。(用含c1 和c2的代数式表示)
(4)某温度时,一定量的元素A的气态氢化物AH3,在恒温密闭容器中分解为两种气体单质,此时压强增加了75%,则AH3分解反应的化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com