
【题目】有机物E和F可用作塑料增塑剂或涂料中的溶剂。它们的相对分子质量相等,可用以下方法合成:

(1)有机物的名称:A__________、B_____。
(2)写出下列化学方程式:
A+D→E_________________________,
B+G→F____________________________________________ 。
(3)X反应的类型及条件:类型_____,条件_____。
(4)E和F的相互关系属____________(多选扣分)。
①同系物②同分异构③同一物质④同一类物质
【答案】 对苯二甲醇 对苯二甲酸 
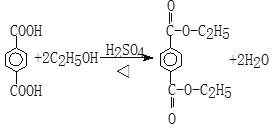 取代 光 ② ④
取代 光 ② ④
【解析】![]() 在光照条件下发生取代反应生成
在光照条件下发生取代反应生成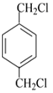 ,
, 在氢氧化钠水溶液、加热条件下发生水解反应生成A为
在氢氧化钠水溶液、加热条件下发生水解反应生成A为![]() ,A发生氧化反应生成B,对二甲苯氧化也得到B,则B为
,A发生氧化反应生成B,对二甲苯氧化也得到B,则B为![]() 。由转化关系可知,乙醛氧化生成D为CH3COOH,D与A发生酯化反应生成E为
。由转化关系可知,乙醛氧化生成D为CH3COOH,D与A发生酯化反应生成E为![]() 。乙烯与水发生加成反应生成G为CH3CH2OH,G与B发生反应生成F为
。乙烯与水发生加成反应生成G为CH3CH2OH,G与B发生反应生成F为![]() ,据此解答。
,据此解答。
(1)根据以上分析可知有机物A是对苯二甲醇,B对苯二甲酸。
(2)A+D→E_是酯化反应,方程式为 ;B+G→F也属于酯化反应,方程式为
;B+G→F也属于酯化反应,方程式为 。
。
(3)根据以上分析可知X反应是![]() 在光照条件下发生取代反应生成
在光照条件下发生取代反应生成 ;
;
(5))E为![]() 、F为
、F为![]() ,二者分子式相同,结构不同,互为同分异构体,均属于酯类,所以②④正确。
,二者分子式相同,结构不同,互为同分异构体,均属于酯类,所以②④正确。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】把11.2 g铁加入到500 mL盐酸中,在标准状况下放出氢气的体积是3.36 L,盐酸的物质的量浓度是( )
A.0.2 mol·L-1B.0.3 mol·L-1C.0.4 mol·L-1D.0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、MgO少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
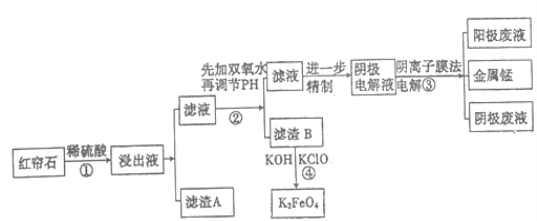
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________________________________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_________________________。
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________ L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的化工原料F(C5H8O4)有特殊的香味,可通过如图所示的流程合成:

已知:①X是石油裂解气主要成分之一,与乙烯互为同系物;
② ;
;
③C、E、F均能与NaHCO3生成气体
(1)D中所含官能团的名称是_______________。
(2)反应②的化学方程式为_____________,反应类型是________;反应⑥的化学方程式为______________。
(3)F的同分异构体很多,其中一种同分异构体只含有一种官能团,在酸性或碱性条件下都能水解生成两种有机物,该同分异构体的结构简式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知X、Y为短周期元素,两元素形成化合物XY2,已知其原子序数分别为a和b,则a不可能为( )
A. b+4 B. b-5 C. b+6 D. b+8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 在水玻璃溶液中通入少量CO2:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
B. 向0.1L5mol·L-1亚硫酸氢铵溶液中逐滴加入0.1L7mol·L-1 NaOH溶液:2NH![]() +5HSO3-+7OH-===2NH3·H2O+5SO
+5HSO3-+7OH-===2NH3·H2O+5SO![]() +5H2O
+5H2O
C. Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
D. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=AlO2-+2H2O+4NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常采用粗锌与稀硫酸制氢气,因此制氢废液中含有大量的硫酸锌,同时含少量硫酸亚铁、硫酸铅等杂质。由制氢废液制备硫酸锌晶体(ZnSO4·7H2O)的流程如下:

下列说法不正确的是
A. 步骤①,涉及的化学反应为:2Fe2++H2O2+2H+=2Fe3++2 H2O
B. 步骤②,加入适量ZnO的目的是:调节溶液pH,沉淀Fe3+
C. 步骤④,涉及的操作有:蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D. 步骤⑤,产物一定是:ZnO和SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com