
| A. | ②④⑥ | B. | ①③⑤⑦ | C. | ②④⑥⑦ | D. | ①⑤⑥⑦ |
分析 ①元素的非金属性越强,其氢化物的热稳定性越强;
②金属晶体熔沸点与电荷成正比与半径成反比;
③第ⅠA、ⅡA族元素的阳离子与其上一周期稀有气体元素的原子具有相同的核外电子排布;
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素;
⑤氢化物的熔沸点与相对分子质量成正比其还与氢键有关;
⑥1mol纯净物完全燃烧生成稳定氧化物放出的热量为燃烧热;
⑦分子的稳定性与化学键的键能有关.
解答 解:①非金属性:F>O>S,元素的非金属性越强,对应的氢化物越稳定,则热稳定性:HF>H2O>H2S,故①错误;
②金属晶体中原子半径越小、金属离子所带电荷越多,金属键的越强,熔点越高,原子半径:Al<Na<K,则金属键:Al>Na>K,金属键的作用力越弱,熔点越低,则熔点:Al>Na>K,故②正确;
③金属失电子形成阳离子,与上一周期稀有气体元素的原子具有相同的核外电子排布,所以第ⅠA、ⅡA族元素的金属阳离子与上一周期稀有气体元素的原子具有相同的核外电子排布,故③错误;
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素属于过度元素全部为金属元素,又称为过渡元素,故④正确;
⑤氢化物分子间含有氢键的沸点较高,则沸点:PH3<AsH3<NH3,故⑤错误;
⑥1mol纯净物完全燃烧生成稳定氧化物放出的热量为燃烧热,已知2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1,则氢气的燃烧热为285.5kJ•mol-1,故⑥正确;
⑦分子的稳定性与化学键的键能有关,因为白磷中共价键的键能小于氮气中共价键的键能,键能越大,分子越稳定,所以非金属性:P<N,故⑦错误.
故选B.
点评 本题考查元素周期律及物质性质,为高频考点,明确化学键与分子间作用力区别、物质性质及基本概念是解本题关键,注意:化学键影响分子稳定性、分子间作用力影响分子晶体熔沸点,为易错点.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2溶液 | B. | CuSO4溶液 | C. | FeCl3溶液 | D. | Al2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、SO42-、H2O2 | B. | SO32-、MnO4-、H+、K+ | ||
| C. | Pb2+、K+、SO42-、Cl- | D. | Na+、SO32-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
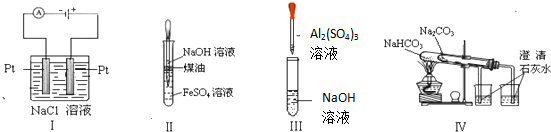
| A. | 实验Ⅰ:制取金属钠 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:制取少量的氢氧化铝 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(KJ/mol) | 615.3 | 414.4 | 347.4 | 435.3 |
| A. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6KJ/mol | |
| B. | NH3+H3O+=NH4++H2O,说明NH3结合H+能力比H2O强 | |
| C. | 室温下,用0.100mol.L-1NaOH溶液滴定20.00mL0.100mol.L-1的醋酸,V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$<1 | |
| D. | 已知中和热为-57.4KJ/mol,则NaOH(aq)+CH3COOH(aq)=CH3COONa+H2O(l)△H=-57.4KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com