
下列说法正确的是
| A.天然油脂的分子中含有酯基,属于酯类 |
| B.煤经处理变为气体燃料的过程属于物理变化 |
| C.A12O3可以与水反应得到其对应水化物 Al(OH)3 |
| D.可以用加热使蛋白质变性的方法分离提纯蛋白质 |
科目:高中化学 来源:2013-2014广东肇庆市毕业班第二次模拟考试理综化学试卷(解析版) 题型:填空题
.(15分)药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(1,4-环己二酮单乙二醇缩酮)和Y(咖啡酸)为原料合成,如下图:
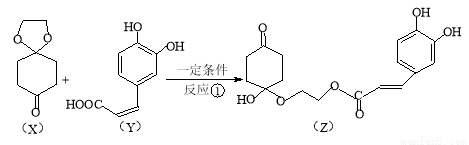
(1)化合物X的有 种化学环境不同的氢原子。
(2)下列说法正确的是 。
A.X是芳香化合物 B.Ni催化下Y能与5molH2加成
C.Z能发生加成、取代及消去反应 D.1mol Z最多可与5mol NaOH反应
(3)Y与过量的溴水反应的化学方程式为 。
(4)X可以由 (写名称)和M( )分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
)分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
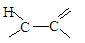 )。
)。
(5)Y也可以与环氧丙烷(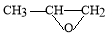 )发生类似反应①的反应,其生成物的结构简式为 (写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有 种。
)发生类似反应①的反应,其生成物的结构简式为 (写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有 种。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应中,在高温下不能自发进行的是( )
A.CO(g) C(s)+O2(g) C(s)+O2(g) |
B.NH4Cl(s) NH3(g)↑+HCl(g)↑ NH3(g)↑+HCl(g)↑ |
C.(NH4)2CO3(s) NH4HCO3(s)+NH3(g) NH4HCO3(s)+NH3(g) |
D.MgCO3(s) MgO(s)+CO2(g) MgO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________
(2)甲试管中混合溶液的加入顺序:___________________________________;
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
| A.中和乙酸和乙醇。 |
| B.中和乙酸并吸收部分乙醇。 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。 |
| D.加速酯的生成,提高其产率。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 下列说法中不正确的是
下列说法中不正确的是
A.高吸水性树脂属于功能高分子材料
B.SiC、Al2O3的熔点很高,可用作高温结构陶瓷
C.光导纤维、合成纤维和人造纤维都是有机高分子化合物
D.合金拓展了金属材料的使用范围,合金中也可能含有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学与生活密切相关,以下说法不正确的是
| A.CaO能与SO2反应,可作燃煤的脱硫剂 |
| B.食醋可用于除去暖水瓶中的水垢 |
| C.明矾水解时产生具有吸附性的胶体粒子,可作净水剂 |
| D.铁在空气中易形成致密的氧化膜,可用来运输浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下: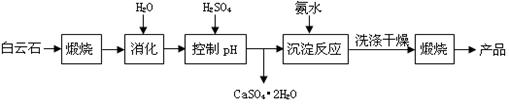
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石 。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 (填序号)。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:
①pH过高会导致___________________________下降,其原因是_______________________
②pH过低会引起____________________________ ,其原因可能是__________(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质 B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
有五种原子序数在36以内的元素A、B、C、D、E,它们的原子序数依次增大,A原子的最外层电子数等于其电子层数,A、B、C原子核外电子层数之和是6,C原子的电子数为A和B两元素原子电子总数的两倍;D和C的最高价氧化物对应水化物的酸性前者强于后者;E可和C形成原子个数比为1:1和1:2的两种化合物,其中一种物质是工业合成硫酸的常见原料,这两种化合物的摩尔质量相差32。试回答下列问题:
(1)E在周期表中的位置是 ,基态B原子的价电子排布式 。
(2)写出CD2的电子式 ,根据价层电子对互斥(VSEPR)理论推测,CD2分子的空间构型为 ,该分子是 分子(填“极性”或“非极性”)。
(3)通常情况下,AB3为无色有刺激性气味的液体,沸点303.8K,熔点193K。AB3固态时的晶体类型为 ;其水溶液有弱酸性,它的电离方程式为 。
(4)下列性质可作为比较C、D两元素非金属性强弱依据的是 (填编号)。
①C、D的最高价氧化物对应水化物的酸性强弱
②C、D的气态氢化物的水溶液的酸性强弱
③C、D的气态氢化物的稳定性强弱
④C、D的简单离子是否易被E3+氧化
⑤相同条件下,C、D的钠盐溶液的碱性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com