
| A. | C3H5Cl | B. | C3H8 | C. | C2H6O | D. | C2H4O2 |
分析 同分异构体是分子式相同,但结构不同的化合物;根据是否存在同分异构体判断正误.
解答 解:A.C3H5Cl可以是含有碳碳双键的卤代烃,也可以环丙烷的一氯取代物,存在同分异构体,所以不能只表示一种物质,故A错误;
B.C3H8为丙烷,只有一种结构,不存在同分异构体,所以能只表示一种物质,故B正确;
C.C2H6O存在2种同分异构体:CH3CH2OH,CH3OCH3,所以不能只表示一种物质,故C错误;
D.C2H4O2存在2种同分异构体:CH3COOH,HCOOCH3,所以不能只表示一种物质,故D错误.
故选B.
点评 本题考查同分异构体,难度不大,注意纯净物必须是由同一种物质组成.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H8O的有机物不一定是醇 | |
| B. | 乙烯与溴发生加成反应生成1,2-二溴乙烷 | |
| C. | 蛋白质、葡萄糖、脂肪在一定条件下都能发生水解反应 | |
| D. | 用乙醇和浓H2SO4 制备乙烯时,温度计的水银球应浸没于液面下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-n | B. | a+m | C. | a-m | D. | a+n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
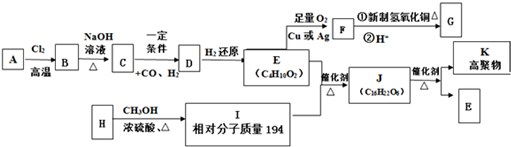
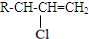
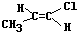 .
.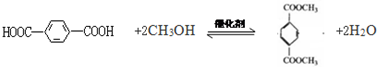 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
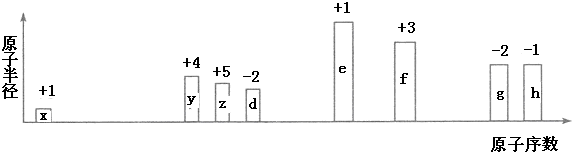
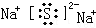 .化合物中离子半径较大的是S2-(填离子符号).
.化合物中离子半径较大的是S2-(填离子符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
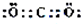 .过量该物质与偏铝酸钠溶液反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
.过量该物质与偏铝酸钠溶液反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H2 | B. | C2H6 C3H6 | C. | C2H4 C3H6 | D. | C2H4 C3H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com