
����Ŀ��������������д��ȷ����
A. 2H2��g��+O2��g��=2H2O��g����H=-483��6kJ��mol��1����1mol������ȼ���ȴ���241.8 kJ��mol��1
B. H2��g��+F2��g��=2HF��g����H=-270kJ��mol��1������ͬ�����£�2molHF�������������1mol������1mol ����������֮��
C. ��20��0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28��7kJ�����������ʾ���кͷ�Ӧ���Ȼ�ѧ����ʽΪNaOH+HCl=NaCl+H2O��H=-57��4kJ��mol��1
D. 500�桢30MPaʱ��������ӦN2��g��+3H2��g��![]() 2NH3��g�� ��H=-38��6kJ��mol��1���ڴ������½�1��5molH2����N2��ַ�Ӧ���ų�����19��3kJ
2NH3��g�� ��H=-38��6kJ��mol��1���ڴ������½�1��5molH2����N2��ַ�Ӧ���ų�����19��3kJ
���𰸡�A
��������
A��ˮ��������Һ��Ҫ�ų�������
B����Ӧ�������ɷ�Ӧ�����������������Ĵ�С��ϵ������
C���Ȼ�ѧ����ʽҪ�������ʵ�״̬��
D��N2��g��+3H2��g��![]() 2NH3��g���ǿ��淴Ӧ����Ӧ�ﲻ��ȫ����Ӧ��
2NH3��g���ǿ��淴Ӧ����Ӧ�ﲻ��ȫ����Ӧ��
A�� 2H2��g��+O2��g��=2H2O��g����H=-483��6kJ��mol��1��ˮ��������Һ��Ҫ�ų���������1mol������ȼ���ȴ���241.8 kJ��mol��1����A��ȷ��
B�����Ȼ�ѧ����ʽH2��g��+F2��g��=2HF��g����H=-270 kJ��mol��1��֪����Ӧ���ȣ���1 mol������1 mol����������������2 mol�����������������B����
C���Ȼ�ѧ����ʽû�б������ʵ�״̬����C����
D��H2�����ʵ���Ϊ1.5mol����ȫ����1.5mol������ų�19.3kJ���������ڸ÷�ӦΪ���淴Ӧ��������������ȫת���ɰ��������Էų�������С��19.3kJ����D����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ba(OH)2��Һ����μ���ϡ���ᣬ������������⣺
��1��д����Ӧ�����ӷ���ʽ_____________________________________________��
��2��������������£����ӷ���ʽ�루1����ͬ����______(�����)��
A����NaHSO4��Һ�У���μ���Ba(OH)2��Һ����Һ������
B����NaHSO4��Һ�У���μ���Ba(OH)2��Һ��SO42��ǡ����ȫ����
C����NaHSO4��Һ�У���μ���Ba(OH)2��Һ������
��3������������ϡ����ֱ�����������������л����Һ�ĵ�������(�õ���ǿ��I��ʾ)�ɽ��Ƶ�����ͼ�е�__________���߱�ʾ(�����)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ�����ǿ������Һ�У����и��������ܴ����������
A.K+��Fe2+��NO3-B.Cu2+��SO42-��NO3-C.Fe3+��Cl-��SCN- D.Na+��OH-��CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ��
A. ��ʯī���缫���CuCl2��Һ��2Cl��+2H2O![]() 2OH��+Cl2��+H2��
2OH��+Cl2��+H2��
B. 0.01mol/LNH4Al(SO4)2��Һ��0.02mol/LBa(OH)2��Һ�������ϣ�Al3++2SO42��+2Ba2++4OH��=2BaSO4��+AlO2��+2H2O
C. ��������������ͨ�����������Һ��SO2+ClO��+2OH��=SO42��+Cl��+H2O
D. Ca(HCO3)2��Һ�����NaOH��Һ��Ӧ��Ca2++HCO3��+OH��=CaCO3+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���»����������ҹ�����������ȼ�ϵ�ؼ����з�ȡ����ͻ�ơ���ѧ�����øü���ʵ����H2S������Դ�������������õ��������ԭ����ͼ��ʾ������˵����ȷ����

A. �缫bΪ��ظ���
B. ��·��ÿ����4mol���ӣ���������44.8LH2S
C. �缫b�ϵĵ缫��ӦΪ��O2+4e-��4H+=2H2O
D. �缫a�ϵĵ缫��ӦΪ��2H2S+2O2--4e-=S2+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ȷ����
A. ����ʽ����CnH2n+2����һ�������� B. ������������ˮ����ȡ����Ӧ
C. ��������ۡ��е���춡��ĸ� D. �������ܱ����Ը��������Һ��ǿ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������½��з�Ӧ��COCl2(g) ![]() Cl2(g)��CO(g)����2.0 L�����ܱ������г���1.0 mol COCl2(g)����Ӧ�����в�õ��й����ݼ��±���
Cl2(g)��CO(g)����2.0 L�����ܱ������г���1.0 mol COCl2(g)����Ӧ�����в�õ��й����ݼ��±���
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
����˵������ȷ����( )
A. ����Cl2��ƽ����Ӧ���ʣ�0��2s��2��4s��B. 0��2s COCl2��ƽ���ֽ�����Ϊ0.15mol��L��1��s��1
C. 6sʱ����Ӧ�ﵽ�����D. �������£�COCl2�����ת����Ϊ40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��5�����ε��ܶȻ�����(Ksp)�ֱ���:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8��10-10 | 1.4��10-5 | 6.3��10-50 | 7.7��10-13 | 8.51��10-16 |
����˵������ȷ����
A. �Ȼ������廯���͵⻯�����ܽ�����μ�С
B. ���������ܽ���ˮ�������м����������ƹ��壬�ܵõ���ɫ����
C. ��5mL1.5��10-5mol/L��NaCl��Һ�У�����1��(1mLԼ20��)1.0��10-3mol/L��AgNO3��Һ�����ܹ۲쵽��ɫ����
D. ���ձ��з���6.24g���������壬��200gˮ��������ܽ�����ñ�����Һ�����Ϊ200mL,��Һ��Ag+�����ʵ���Ũ��Ϊ0.2mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע������Ϊ��ȡCu2O�����ַ���:
����a:��̿���ڸ��������»�ԭCuO
����b:��ⷨ����ӦΪ2Cu+H2O![]() Cu2O+H2��
Cu2O+H2��
(1)��֪:��2Cu(s)+![]() O2(g)=Cu2O(s)��H1=akJ/mol
O2(g)=Cu2O(s)��H1=akJ/mol
��C(s)+![]() O2(g)=CO(g) ��H2=bkJ/mol
O2(g)=CO(g) ��H2=bkJ/mol
��Cu(s)+![]() O2(g)=CuO(s)��H3=ckJ/mol
O2(g)=CuO(s)��H3=ckJ/mol
��a�з�Ӧ���Ȼ�ѧ����ʽ��:_________________��
(2)����b������ȼ�ϵ��Ϊ��Դ��ͨ�����ӽ���Ĥ��ⷨ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2Oװ����ͼ��ʾ:
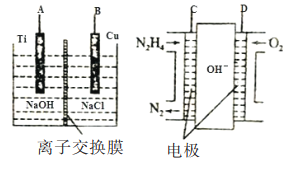
����ͼװ����D�缫Ӧ��______�缫��(�A����B��)
�ڸ����ӽ���ĤΪ______���ӽ���Ĥ(�����������)���õ��ص�B����ӦʽΪ:______��
��C����ӦʽΪ:__________��
(3)����ͬ����ĺ����ܱ������У������Ϸ����Ƶõ�����Cu2O�ֱ���д��ֽ�ˮ��ʵ��:
2H2O![]() 2H2(g)+O2(g) ��H>0��ˮ������Ũ����ʱ��t�仯�����ʾ:
2H2(g)+O2(g) ��H>0��ˮ������Ũ����ʱ��t�仯�����ʾ:
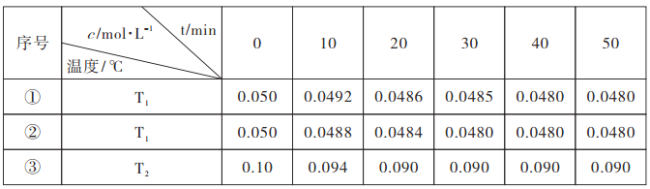
�����������ݷ���:
�ٴ�����Ч��:ʵ���_______ʵ���(�>����<��)��
��ͨ��ʵ��١��۷���,T1______T2(�>����<��)��
��ʵ��١��ڡ��۵Ļ�ѧƽ�ⳣ��K1��K2��K3�Ĵ�С��ϵΪ:_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com