
【题目】一定条件下进行反应:COCl2(g) ![]() Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是( )
A. 生成Cl2的平均反应速率,0~2s比2~4s快B. 0~2s COCl2的平均分解速率为0.15mol·L-1·s-1
C. 6s时,反应达到最大限度D. 该条件下,COCl2的最大转化率为40%
【答案】B
【解析】
A.根据表中数据可以知道,在0~2s中氯气变化了0.3mol,在2~4s中氯气变化了0.09mol,所以生成Cl2的平均反应速率,0~2s比2~4s快,故A正确;
B.在0~2s中氯气变化了0.3mol,根据化学方程式COCl2(g)![]() Cl2(g)+CO(g)可以知道,用去COCl2气体的物质的量为0.3mol,所以0~2sCOCl2的平均分解速率为
Cl2(g)+CO(g)可以知道,用去COCl2气体的物质的量为0.3mol,所以0~2sCOCl2的平均分解速率为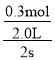 =0.075mol·L-1·s-1,故B错误;
=0.075mol·L-1·s-1,故B错误;
C.6s之后,氯气的物质的量不再变化,说明反应已经处于平衡状态,反应达到最大限度,故C正确;
D.根据表中数据,平衡时生成氯气0.4mol,即用去COCl2气体的物质的量为0.4mol,所以转化率=![]() ×100%=40%,故D正确。
×100%=40%,故D正确。
故选B。


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】已知:常温下甲胺(CH3NH2)的电离常数kb,pkb=-lgkb=3.4。CH3NH2+H2O![]() CH3NH3++OH-。下列说法不正确的是( )
CH3NH3++OH-。下列说法不正确的是( )
A. (CH3NH3)2SO4溶液中离子浓度:c(CH3NH3+)>c(SO42-)>c(H+)>c(OH-)
B. 常温下,pH=3的盐酸溶液和pH=11的CH3NH2溶液等体积混合,混合溶液呈酸性
C. 用标准浓度的盐酸滴定未知浓度的CH3NH2溶液的实验中,选择甲基橙作指示剂
D. 常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=10.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述或书写正确的是
A. 2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1,则1mol氢气的燃烧热大于241.8 kJ·mol-1
B. H2(g)+F2(g)=2HF(g)ΔH=-270kJ·mol-1,则相同条件下,2molHF气体的能量大于1mol氢气和1mol 氟气的能量之和
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该中和反应的热化学方程式为NaOH+HCl=NaCl+H2OΔH=-57.4kJ·mol-1
D. 500℃、30MPa时,发生反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1。在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
2NH3(g) ΔH=-38.6kJ·mol-1。在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物提取物-香豆素,可用于消灭鼠害。其分子球棍模型如图所示。由C、H、0三种元素组成。下列有关叙述不正确的是( )
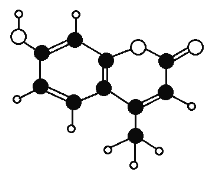
A. 该分了中不含手性碳原子
B. 分子式为C10H8O3
C. 能使酸性KMnO4溶液褪色
D. lmol香豆素最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝及其化合物的说法中不正确的是
A.氧化铝可用于工业制铝
B.氧化铝可用于制造耐火材料
C.明矾是一种常见的净水剂
D.铝槽车可用于稀硝酸的贮运
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应:X2+3Y2![]() 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是

A. t2~t3时,各物质的浓度不再发生变化 B. t2时,反应未达到限度
C. t2~t3时,反应已停止进行 D. t1时,反应只向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com