
【题目】下列污水处理的方法中,表示其原理的离子方程式不正确的是( )
A.混凝法,用明矾做混凝剂:Al3++3H2O ![]() Al(OH)3+3H+
Al(OH)3+3H+
B.中和法,用过量CO2中和碱性废水:CO2+2OH-=CO32-
C.沉淀法,用Na2S处理含Hg2+废水:Hg2++S2-=HgS↓
D.氧化还原法,用FeSO4将酸性废水中Cr2O72—还原为Cr3+:Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
【答案】B
【解析】A.混凝法,用明矾做混凝剂,是因为铝离子水解生成氢氧化铝胶体,离子方程式为Al3+ + 3H2O ![]() Al(OH)3 + 3H+,故A不符合题意;
Al(OH)3 + 3H+,故A不符合题意;
B、过量CO2中和碱性废水反应生成碳酸氢根:CO2 + OH-= HCO3-,故B符合题意;
C.用Na2S处理含Hg2+废水生成硫化汞沉淀:Hg2+ + S2-= HgS↓,故C不符合题意;
D.FeSO4将酸性废水中Cr2O72-还原为Cr3+,本身被氧化为铁离子,Cr2O72-+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,故D不符合题意。
故答案为:B
A.氯离子水解生成氢氧化铝胶体;
B.过量二氧化碳与氢氧根离子反应生成碳酸氢盐;
C.硫离子与汞离子反应生成硫化汞沉淀;
D.亚铁盐被氧化物铁盐,含铬化合物被还原.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】(一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,属于强电解质的是___ __,属于非电解质的是___ _____(均填序号)
①Cu②液氨③氯水④氯化钠晶体⑤硫酸溶液⑥干冰⑦BaSO4⑧液氧⑨金刚石⑩石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用.某含砷元素(As)的工业废水经如图1流程转化为粗As2O3 . 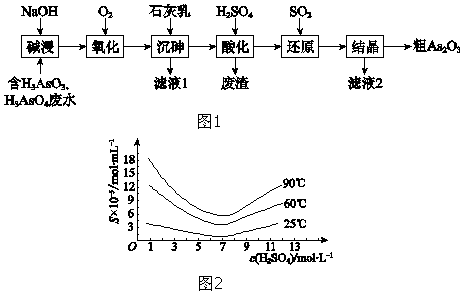
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐.H3AsO4转化为Na3AsO4反应的化学方程式是 .
(2)“氧化”时,1mol AsO33﹣转化为AsO43﹣至少需要O2mol.
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有: a.Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)△H<0
b.5Ca2++OH﹣+3AsO43﹣Ca5(AsO4)3OH△H>0
研究表明:“沉砷”的最佳温度是85℃.
用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是 .
(4)“还原”过程中H3AsO4转化为H3AsO3 , 反应的化学方程式是 .
(5)“还原”后加热溶液,H3AsO3分解为As2O3 , 同时结晶得到粗As2O3 . As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示.为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是 .
(6)下列说法中,正确的是(填字母). a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用符号A:质子数,B:中子数,C:核外电子数,D:最外层电子数,E:电子层数,填写下列各空。
(1)原子种类由_____决定。
(2)元素的种类由_____决定
(3)元素的化合价主要由____决定
(4)核电荷数由_____决定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究并回答问题
(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| A | B | C | D | E | F |
4molL﹣1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= , V6= , V9=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
(2)在100℃和200kPa的条件下,反应aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
压强(kPa) | 200 | 500 | 1 000 |
B的浓度(molL﹣1) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡移动(填“正向”“逆向”或“不”),理由是 .
②压强从500kPa增加到1 000kPa时,平衡转移(填“正向”“逆向”或“不”),其原因可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1)B、C、D、E 4种物质的化学式为:
B____________、C____________、D____________、E____________。
(2)沉淀F与NaOH溶液反应的离子方程式为________________________________。
沉淀E与稀硫酸反应的离子方程为____________________________________。
溶液G与过量稀氨水反应的化学方程为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com