
【题目】某蛋白质的相对分子质量为11 935,在合成这个蛋白质分子的过程中脱水总相对分子质量为1 908,若氨基酸的平均相对分子质量为127,则组成该蛋白质分子的肽链数有
A. 1条 B. 2条 C. 3条 D. 4条
科目:高中化学 来源: 题型:
【题目】某精细化工厂将棉花加工成很细的颗粒结构,然后添加到食品中去,可改变食品的口感,使食品易于加工成型,降低人体获得的热量等。这是因为纤维素( )
A.是人体重要的营养物质
B.不能被人吸收,但可促进消化
C.在人体内可水解成葡萄糖
D.不能被所有动物吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
①汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
②若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线。______________

(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。

下列有关说法不正确的是_____(填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
②若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为________。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)在自然界一般以硫化物的形式存在,我国锑的在蕴藏量为世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原: ①2Sb2S3+6Fe+3O2![]() Sb4O6+6FeS ②Sb4O6+6C
Sb4O6+6FeS ②Sb4O6+6C![]() 4Sb+6CO↑
4Sb+6CO↑
关于反应①、②的说法正确的是( )
A. 反应①②中的氧化剂分别是Sb2S3、Sb4O6
B. 反应①中每生成3molFeS时。共转移6mol电子
C. 反应②说明高温下C的还原性比CO强
D. 每生成4molSb时,反应①与反应②中还原剂的物质的量之比为4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗。其制备过程如图所示、下列叙述不合理的是
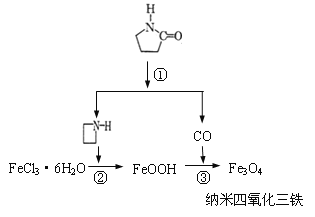
A.在反应②中,![]() 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解
B.反应③的化学方程式是:6FeOOH + CO ==2Fe3O4+3H2O+CO2
C.直接加热FeCl3溶液也可以得到四氧化三铁
D.纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空 :
(1)高分子化合物![]() 单体结构简式为_____________________。
单体结构简式为_____________________。
(2)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成_______________________。
(3)与![]() 互为同分异构体的芳香族化合物有________种,列举三种结构简式(要求不同类别)________________________________。
互为同分异构体的芳香族化合物有________种,列举三种结构简式(要求不同类别)________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。
实验 | 实验及操作 | 现象 | |
| 试管 | 滴管 | |
I.饱和Na2SiO3溶液(含2滴酚酞) | 先滴加1.0ML0.5mol/LNaOH溶液;再滴加1.0mol/LH2SO4溶液 | 红色溶液中出现胶状沉淀 | |
II.0.1mol/LAlCl3溶液 | 加碱时______;加酸时产生白色沉淀,又逐渐溶解至消失 | ||
Ⅲ.0.1mol/LFe(NO3)2溶液 | 加碱时______;加酸后得黄色溶液 | ||
Ⅳ.新制饱和氯水 | 加碱时溶液变为无色;加酸后______。 | ||
(1)用离子方程式解释现象1中出现胶状沉淀的原因:______________。
(2)II中加碱时出现的现象是__________,现象说明溶液中发生反应的离子方程式是________。
(3) Ⅲ中加碱时出现的现象是______________。
(4)IV中加酸时出现的现象是_________,用离子方程式解释产生此现象的原因_________。
(5)滴加试剂顺序的变化。会影响溶液中的现象和发生的反应。请继续分析以下实验。
实验 | 实验及操作 | 现象 | |
| 试管 | 滴管 | |
0.1mol/LFe(NO3)2溶液 | 先滴加1.0mol/LH2SO4溶液;再滴加1.0mL0.5mol/LNaOH溶液; | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 | |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL0.1mol/L Fe(NO3)2溶液中____________,如果溶液变红色。说明溶液中含Fe3+,证明加酸时溶液中发生了反应。(请将上述操作补充充整)
②推测溶液中产生Fe3+的可能原因有两种:
I.__________________;Ⅱ.______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
(1)在如图所示仪器中,配制上述溶液肯定不需要的是(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 . 
(2)在容量瓶的使用方法中,下列操作不正确的是 .
A.容量瓶洗涤后残留少量水不影响使用
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制NaOH溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制硫酸溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次摇匀.
(3)用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(保留到小数点后1位.),若实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com