
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
①汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
②若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线。______________

(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。

下列有关说法不正确的是_____(填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
②若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为________。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为___________________________________。
【答案】 -746.5 kJ·mol-1 低温 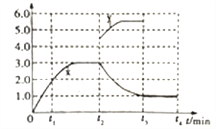 A 7.7% 或0.077 2CO2+12H++12e﹣=CH2=CH2+4H2O
A 7.7% 或0.077 2CO2+12H++12e﹣=CH2=CH2+4H2O
【解析】(1)①已知:
Ⅰ:C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
Ⅱ:2C(s)+O2(g)=2CO(g) △H2=-221 kJ·mol-1
Ⅲ:N2(g)+O2(g)=2NO(g) △H3=+180.5 kJ·mol-1
根据盖斯定律可知Ⅰ×2-Ⅱ-Ⅲ即得到反应Ⅳ:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的反应热△H=-746.5kJ·mol-1,由于正反应体积减小,即△S<0,根据△G=△H-T·△S<0可知该反应能自发进行的条件是低温。②升高温度平衡向逆反应方向进行,氮气浓度减小,达到新平衡时不再发生变化,所以图像可表示为
N2(g)+2CO2(g)的反应热△H=-746.5kJ·mol-1,由于正反应体积减小,即△S<0,根据△G=△H-T·△S<0可知该反应能自发进行的条件是低温。②升高温度平衡向逆反应方向进行,氮气浓度减小,达到新平衡时不再发生变化,所以图像可表示为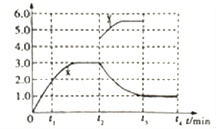 ;(2)①A.温度越高,反应速率越大,但M、N点温度、催化剂均不同,则N点速率不是最大的,A错误;B.温度在约250℃时,催化剂的催化效率对应转化率最大,则催化剂的催化效率最高,B正确;C.转化率越大,乙烯的产量越大,则相同条件下,乙烯的产量M点比N高,C正确;答案选A;②图中M点时,转化率为50%,在密闭容器中充入体积比为3:1的H2和CO2,则
;(2)①A.温度越高,反应速率越大,但M、N点温度、催化剂均不同,则N点速率不是最大的,A错误;B.温度在约250℃时,催化剂的催化效率对应转化率最大,则催化剂的催化效率最高,B正确;C.转化率越大,乙烯的产量越大,则相同条件下,乙烯的产量M点比N高,C正确;答案选A;②图中M点时,转化率为50%,在密闭容器中充入体积比为3:1的H2和CO2,则
6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
起始量(mol)3n n 0 0
转化量(mol)1.5n 0.5n 0.25n n
平衡量(mol)1.5n 0.5n 0.25n n
产物乙烯的体积分数为0.25n/(1.5n+0.5n+0.25n+n)×100%=7.7%或0.077。
(3)电解池的阴极发生得到电子的还原反应,即CO2得到电子转化为乙烯,电极反应式为2CO2+12H++12e﹣=CH2=CH2+4H2O。


科目:高中化学 来源: 题型:
【题目】某工厂的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-离子中的一种或几种,为检验上述离子,某兴趣小组设计了如下实验方案, 下列说法正确的是

A. 沉淀l为BaCO3和BaSO4
B. 沉淀2可能为AgCl和Ag2SO4
C. 该污水中一定存在Fe3+,不存在Fe2+
D. 该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化,不能通过一步反应实现的是( )
A.S→SO2→H2SO4→MgSO4
B.Si→SiO2→Na2SiO3→H2SiO3
C.Al→Al2O3→Al(OH)3→NaAlO2
D.N2→NO→NO2→HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属冶炼的说法正确的是
A. 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定
B. 可以用钠加入氯化镁饱和溶液中制取镁
C. 炼铁高炉中所发生的反应都是放热的,故无需加热
D. 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蛋白质的相对分子质量为11 935,在合成这个蛋白质分子的过程中脱水总相对分子质量为1 908,若氨基酸的平均相对分子质量为127,则组成该蛋白质分子的肽链数有
A. 1条 B. 2条 C. 3条 D. 4条
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC), RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是

A. 转移0.1mol电子时,a电极产生标准状况下O2 1.12L
B. c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
C. b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
D. d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com