
【题目】如图是一定条件下N2与H2反应过程中能量变化的曲线图。下列叙述正确的是

A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热将发生改变
D. 在相同温度的条件下,在体积相同I、II两个容器中分别通入1mol N2和3 mol H2,容器I体积恒定,容器II体积可变保持恒压,则反应过程中两容器内的反应速率v(I)<v(II)
【答案】D
【解析】
A、热化学方程式必须标注物质的聚集状态;B、催化剂能改变反应的路径,使发生反应所需的活化能降低;C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变;D.容器I体积恒定,发生反应N2+3H2![]() 2NH3,物质的量减少,压强变小;容器II保持恒压,所以压强I<II;
2NH3,物质的量减少,压强变小;容器II保持恒压,所以压强I<II;
A、该反应的热化学方程式为:N2(g)+3H2(g)2NH3(g),△H=-92kJmol-1,故A错误;B、催化剂能改变反应的路径,使发生反应所需的活化能降低,所以b曲线是加入催化剂时的能量变化曲线,故B错误;C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故C错误; D、容器I体积恒定,发生反应N2+3H2![]() 2NH3,物质的量减少,压强变小;容器II保持恒压,所以压强I<II,反应速率v(I)<v(II),故D正确。
2NH3,物质的量减少,压强变小;容器II保持恒压,所以压强I<II,反应速率v(I)<v(II),故D正确。


科目:高中化学 来源: 题型:
【题目】下列关系式错误的是( )
A. CO2的水溶液:c(H+)>c(HCO3-)>2c(CO32-)
B. 等浓度的HCN溶液与NaOH溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+)>c(CN-) >c(OH-)>c(H+)
C. NaHCO3溶液中存在水解平衡:HCO3-+H2OH2CO3+OH-
D. 两种弱酸HX和HY混合后,溶液中的c(H+)为(Ka为电离平衡常数) ![]() +
+![]() + c(OH-)
+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述不正确的是

A. 反应的化学方程式为:3N ![]() 2M
2M
B. t2时,正、逆反应速率不相等
C. t3时,正反应速率等于逆反应速率,达到平衡
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)═2NO(g)+O2(g)在体积不变的密闭容器中反应,现有以下几种说法:
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
其中表示反应达到平衡状态的是
A. ①③⑤ B. ②④⑥ C. ②③④⑥ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如下图所示,下列说法错误的是

A. 反应总过程ΔH<0
B. Fe+使反应的活化能减小
C. FeO+也是该反应的催化剂
D. Fe++N2O![]() FeO++N2、FeO++CO
FeO++N2、FeO++CO![]() Fe++CO2两步反应均为放热反应
Fe++CO2两步反应均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠的化合物用途广泛,回答下列问题:
(1)多硫化钠(Na2Sx)用作聚合的终止剂。钠原子价层电子的轨道表达式(电子排布图)为___________,基态S原子电子占据最高能级的电子云轮廓图为___________,其中Na2S4中存在的化学键有:___________。
A.离子键 B.极性共价键 C.π键 D.非极性共价键
(2)r(S2-)>r(Na+)的原因是___________。
(3)Na2SO3常用作工业的脱氧剂和漂白剂,其阴离子的中心原子的杂化形式是___________,空间构型是______________________。
(4)下表列出了钠的卤化物的熔点:
化学式 | NaF | NaCl | NaBr | NaI |
熔点/℃ | 995 | 801 | 775 | 651 |
①NaF的熔点比NaI的熔点高的原因是_________________________________;
②NaCl晶格能是786 kJ/mol,则NaF的晶格能可能是___________。
A. 704 kJ/mol B. 747kJ/mol C 928 kJ/mol
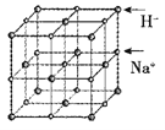
(5)NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,则H-的半径为___________pm;NaH的理论密度是___________g·cm-3(保留三位有效数字)。[H—1、Na—23]
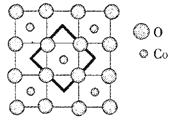
(6)首例被发现的带结晶水的超导材料晶体化学式为Na0.35CoOx·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构,已知CoOx层的构型部分如图,其中粗线画出的是其二维晶跑,则x=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在装有MnO2的试管中加入H2O2可以快速制取O2,回答下列问题:
(1)H2O2中O的化合价是_____,写出H2O2中含有的化学键类型____(填字母序号)。
A.极性共价键 B.非极性共价键 C.离子键
(2)写出该反应的化学方程式 _______。
(3)MnO2的作用是______。
(4)下列措施可以加快该化学反应速率的是_______。
A.滴加FeCl3溶液 B.加热 C.降低压强 D.增大H2O2的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com