
【题目】实验室用镁和硝基苯制取反式偶氮苯(溶解性:不溶于水,溶于醇、醚)。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→ +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
实验流程如下:

(1)反应中,硝基苯变为反式偶氮苯的反应属于_______________
A、取代反应 B、消去反应 C、还原反应 D、氧化反应
(2)在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁屑应该_______________________________________。

(3)反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤(抽滤装置如图1),滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要____________(填“缓慢加入”、“快速加入”)。
②抽滤过程中要洗涤粗产品,下列液体最合适的是___________。
A.乙醚 B.蒸馏水 C.95%乙醇水溶液 D.饱和NaCl溶液
③抽滤完毕,应先断开橡皮管______________(填序号),以防倒吸。
④重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的________________________操作除去了可溶性杂质。
(4)已知薄层色谱分析中,分子极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图2所示。展开后的斑点中,顺式偶氮苯为______(填斑点序号),说明顺式偶氮苯的分子极性比反式偶氮苯的分子极性__________(填“强”或“弱”)。
【答案】 C 除去表面的氧化物 缓慢加入 B b 抽滤 3 强
【解析】分析:(1)根据反应中去掉氧原子分析反应类型;
(2)镁易被氧化,故镁条表面有氧化物,需用砂纸打磨干净;
(3)①结晶速度越慢可得到较大颗粒的晶体;
②根据反式偶氮苯的溶解性解答;
③从防倒吸的角度去分析;
④趁热过滤可以除去不溶性杂质;
(4)极性弱的物质,在溶剂中扩散更快,根据图可知展开后顺式偶氮苯较多,扩散较慢。
详解:(1)硝基苯在反应中去掉氧原子,属于去氧的反应,因此硝基苯变为反式偶氮苯的反应属于还原反应,答案选C;
(2)由于镁易被氧化,故镁条表面有氧化物,因此反应加入的镁屑应该除去表面的氧化物。
(3)①结晶速度越慢可得到较大颗粒的晶体,故应缓慢加入乙酸;
②反式偶氮苯不溶于水,溶于醇、醚,所以洗涤最好选择蒸馏水,答案选B;
③抽滤完毕,应先断开抽气泵和安全瓶之间的橡皮管,以防止倒吸,答案选b;
④重结晶过程:加热溶解→趁热过滤→冷却结晶→抽滤→洗涤→干燥,其中趁热过滤可以除去不溶性杂质,冷却结晶,抽滤可以除去可溶性杂质;
(3)极性弱的物质,在溶剂中扩散更快,根据图可知展开后顺式偶氮苯较多,扩散较慢,即展开后的斑点中,顺式偶氮苯为3,这说明顺式偶氮苯比反式偶氮苯的分子极性较强。


科目:高中化学 来源: 题型:
【题目】新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为Mg17Al12+17H2═17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气.下列说法正确的是
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 合金在吸氢过程中被H2还原
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)> V(合金)>V(铝)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量NaHCO3杂质,现用如图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为m1g;
③准确称得m2g纯碱样品放入容器b中;
④打开仪器a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为m3g 。
⑥根据所得数据计算。试回答:
(1)仪器a的名称是___________
(2)装置B中发生反应的离子方程式_____________________________________。
(3)步骤⑤鼓入空气的目的是__________________________________________________。
(4)装置A中试剂X应选用______
A 、NaOH B、浓H2SO4 C、NaHCO3 D、NaCl
(5)如果将a的硫酸换成浓度相同的盐酸,则会导致测定结果______(“偏大”或“偏小”“不变”)
(6)如果除纯碱样品外,没有其他试剂,请设计一个也能测定纯碱样品中Na2CO3的质量分数的实验方案。主要步骤(不需要具体操作)_________________________有关化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______________________________________;
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =__________________;
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:![]() (aq)+I2(aq)+2OH(aq)
(aq)+I2(aq)+2OH(aq)![]()
![]() (aq)+2I(aq)+ H2O(l)。溶液中c(
(aq)+2I(aq)+ H2O(l)。溶液中c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
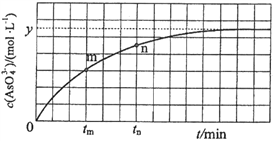
①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I)=2v(![]() )
)
c.c(![]() )/c(
)/c(![]() )不再变化 d.c(I)=y mol·L1
)不再变化 d.c(I)=y mol·L1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图- 1和图- 2所示:
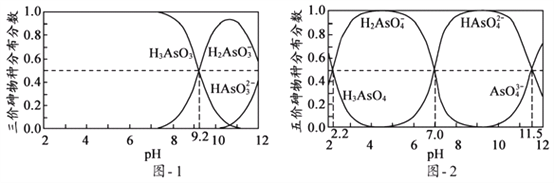
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用如下图装置制备氢氧化亚铁并观察其颜色。

提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
(1)稀硫酸应放在_____________中(填写仪器名称)。
(2)本实验通过控制A、B、C三个开关,可将仪器中的空气排尽,具体操作为:关闭开关_______,打开开关________,打开分液漏斗活塞;待反应一段时间排尽空气后,再关闭开关_______,打开开关_______,就可观察到氢氧化亚铁的颜色。试分析实验开始时需排尽装置中空气的理由_______________________________(用化学反应方程式作答)。
(3)某同学认为本实验中应该用铁钉代替铁粉,他的理由是________________________。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①从摩尔盐水溶液中提取 (NH4)2SO4·FeSO4·6H2O晶体的具体操作是______________,用乙醇洗涤,干燥。
②为了测定产品的纯度,称取10 g产品溶于50 mL水中,配制成250 mL溶液,用浓度为0.01 mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00 mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
通过实验数据计算的该产品纯度为________,上表中第一次实验中记录数据明显大于后两次,其原因可能是________。
A.第一次滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.第一次实验结束时俯视刻度线读取酸性高锰酸钾溶液的体积
C.第一次滴定用的锥形瓶用待测液润洗过
D.第一次实验装高锰酸钾的滴定管清洗后没有润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
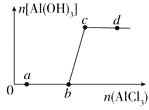
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Ag+、Ca2+、NO3-、F-
C. c点对应的溶液中:Na+、S2-、SO42-、Cl-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 用白醋除铁锈:Fe2O3+6H+==3H2O+2Fe3+
B. 向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-![]() NH3↑+2H2O+BaCO3↓
NH3↑+2H2O+BaCO3↓
C. 氯化亚铁溶液在空气中慢慢滴入过量氨水,产生白色沉淀:Fe2++2NH3H2O=Fe(OH)2↓+2NH4+
D. NH4HS溶液与少量的NaOH溶液反应:NH4++OH-=NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com