
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______________________________________;
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =__________________;
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:![]() (aq)+I2(aq)+2OH(aq)
(aq)+I2(aq)+2OH(aq)![]()
![]() (aq)+2I(aq)+ H2O(l)。溶液中c(
(aq)+2I(aq)+ H2O(l)。溶液中c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
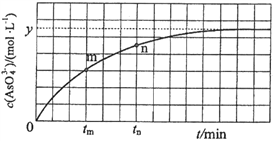
①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I)=2v(![]() )
)
c.c(![]() )/c(
)/c(![]() )不再变化 d.c(I)=y mol·L1
)不再变化 d.c(I)=y mol·L1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图- 1和图- 2所示:
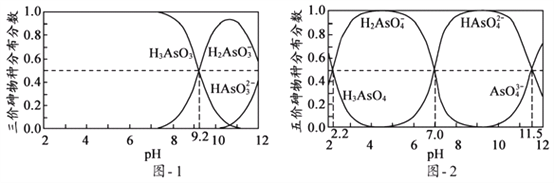
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
【答案】 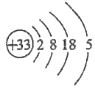 2As2S3+5O2+6H2O=4H3AsO4+6S 2△H1-3△H2-△H3 bd 小于 大于
2As2S3+5O2+6H2O=4H3AsO4+6S 2△H1-3△H2-△H3 bd 小于 大于 ![]() OH- + H3AsO3
OH- + H3AsO3![]() H2AsO3- + H2O 2.2
H2AsO3- + H2O 2.2
【解析】分析:(1)根据As的核外电子排布画出砷的原子结构示意图;
(2)根据电子得失守恒和原子守恒书写方程式;
(3)根据盖斯定律计算;
(4)①根据平衡状态的特征判断;
②根据tm时反应没有达到平衡状态,向正反应方向进行判断;
③根据浓度对反应速率的影响分析;
④根据平衡时离子的浓度结合平衡常数表达式计算;
(5)①根据图像结合溶液颜色变化判断产物;
②根据平衡常数表达式结合图中等浓度点计算。
详解:(1)砷为33号元素,原子结构示意图为 ;
;
(2)根据题干信息可知As2S3+O2→H3AsO4+S,As2S3化合价总共升高10价,利用得失电子守恒配平得:2As2S3+5O2→4H3AsO4+6S,再考虑质量守恒,反应前少了6O、12H,故方程式为2As2S3+5O2+6H2O=4H3AsO4+6S;
(3)已知:
①As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
②H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
③2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
根据盖斯定律可知①×1-②×3-③即得到反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=2△H1-3△H2-△H3;
(4)①a、溶液pH不变时,则c(OH—)也保持不变,能判断反应处于平衡状态,a错误;b、根据速率关系v(I—)=2v(AsO33—),则等式始终成立,不能判断反应处于平衡状态,b正确;c、由于提供的Na3AsO3总量一定,所以c(AsO43—)/c(AsO33—)不再变化,能判断反应处于平衡状态,c错误;d、c(I-)=y mol/L时,即c(AsO43)=c(I-),事实两者浓度关系一定是2c(AsO43)=c(I-),不能判断反应平衡状态,d正确,答案选bd;
②反应从正反应开始进行,tm时反应继续向正反应方向进行,故v逆小于v正;
③tm时比tn时,AsO43—浓度更小,所以逆反应速率也更小,tn时v逆大于tm时v逆;
④反应前,三种溶液混合后,Na3AsO3浓度为![]() ,同理I2的浓度为xmol/L,反应达到平衡时,生成c(AsO43—)为ymol/L,则反应生成c(I—)为2ymol/L,消耗AsO33—、I2浓度均为ymol/L,平衡时c(AsO33—)为(x-y)mol/L、c(I2)为(x-y)mol/L,pH=14,即c(OH—)=1mol/L,则
,同理I2的浓度为xmol/L,反应达到平衡时,生成c(AsO43—)为ymol/L,则反应生成c(I—)为2ymol/L,消耗AsO33—、I2浓度均为ymol/L,平衡时c(AsO33—)为(x-y)mol/L、c(I2)为(x-y)mol/L,pH=14,即c(OH—)=1mol/L,则![]() ;
;
(5)①从题图-1可知pH由小变大时,H3AsO3浓度减小,H2AsO3—浓度增大,当溶液由无色变为浅红色时,主要的离子反应应该为:OH-+H3AsO3=H2AsO3-+H2O;
②H3AsO4的第一步电离方程式为H3AsO4![]() H2AsO4-+H+,其电离常数Ka1=
H2AsO4-+H+,其电离常数Ka1=![]() ,由题图-2可知c(H3AsO4)=c(H2AsO4-),c(H+)=10-2.2mol/L,pKa1=-lgKa1=-lg10-2.2=2.2。
,由题图-2可知c(H3AsO4)=c(H2AsO4-),c(H+)=10-2.2mol/L,pKa1=-lgKa1=-lg10-2.2=2.2。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】用下列方法制取氢气,反应速率最大的是
A.冬天,块状锌与2 mol·L一1硫酸溶液反应
B.冬天,粉末状锌与2 mol·L一1硫酸溶液反应
C.夏天,块状锌与2 mol·L一1硫酸溶液反应
D.夏天,粉末状锌与2mol·L一1硫酸溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物a、b、c广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
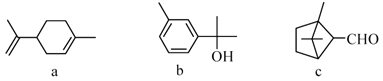
A. b和c互为同分异构体
B. a、b、c分子中所有碳原子不可能处于同一平面上
C. a、b和c均能使溴的四氯化碳溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用镁和硝基苯制取反式偶氮苯(溶解性:不溶于水,溶于醇、醚)。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→ +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
实验流程如下:

(1)反应中,硝基苯变为反式偶氮苯的反应属于_______________
A、取代反应 B、消去反应 C、还原反应 D、氧化反应
(2)在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁屑应该_______________________________________。

(3)反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤(抽滤装置如图1),滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要____________(填“缓慢加入”、“快速加入”)。
②抽滤过程中要洗涤粗产品,下列液体最合适的是___________。
A.乙醚 B.蒸馏水 C.95%乙醇水溶液 D.饱和NaCl溶液
③抽滤完毕,应先断开橡皮管______________(填序号),以防倒吸。
④重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的________________________操作除去了可溶性杂质。
(4)已知薄层色谱分析中,分子极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图2所示。展开后的斑点中,顺式偶氮苯为______(填斑点序号),说明顺式偶氮苯的分子极性比反式偶氮苯的分子极性__________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是
A. 7.8 g Na2O2中含有的阴离子数为0.2NA。
B. 1 mol Fe溶于过量硝酸,电子转移数为2NA
C. 22.4 L(标准状况下)氩气含有的质子数为18NA
D. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2LNO和11.2LO2混合后气体的分子总数为NA
B. 标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA
C. 14g由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA
D. 25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,屠呦呦因发现青蒿素和双氢青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。双氢青蒿素的化学式为C15H24O5,相对分子质量为284。下面关于双氢青蒿素的说法正确的是( )
A. 1 mol双氢青蒿素的质量为284 g· mol-1
B. 双氢青蒿素的摩尔质量等于它的相对分子质量
C. 14.2 g双氢青蒿素中含有的原子总数为2.2NA
D. 含有6.02×1023个碳原子的双氢青蒿素的物质的量为1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com