
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________________。
(2)A和D可形成化合物的化学式为________。
(3)B元素在周期表中的位置为_____________;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为________________。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)__________。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为______,若将该反应设计成原电池,原电池的负极材料为___________。
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为____,能够用于漂白的固体物质中阴、阳离子个数比为_________________。
(7)写出D元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_________________________________________________。
【答案】 ![]() H2O H2O2 第二周期 ⅣA族 CO2+OH-=HCO3- S2-、O2-、Na+、Al3+ 2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑ 铝或Al 共价键 1:2 HS-+OH-=S2-+H2O或H2S+2OH-=S2-+2H2O
H2O H2O2 第二周期 ⅣA族 CO2+OH-=HCO3- S2-、O2-、Na+、Al3+ 2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑ 铝或Al 共价键 1:2 HS-+OH-=S2-+H2O或H2S+2OH-=S2-+2H2O
【解析】B元素一种原子的含量常用于判定古生物遗体的年代,B为碳元素;A和C元素的原子能形成4核10电子的微粒,A为氢元素,C为氮元素;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30,所以各离子核外电子总数为10,所以E为Na元素、D为O元素;G和D同主族,D为硫元素;E、F、G的最高价氧化物对应的水化物之间可以相互反应,F为铝元素;综上分析可知:A为H元素、B为C元素、C为N元素、D为O元素、E为Na元素、F为Al元素、G为S元素;
(1) C为氮元素,原子结构示意图![]() ;正确答案:
;正确答案:![]() 。
。
(2) A和D可形成化合物水和过氧化氢,化学式为H2O 和 H2O2;正确答案:H2O 、H2O2。
(3)碳原子核电荷数为6,在周期表中的位置为第二周期 ⅣA族;过量的二氧化碳与氢氧化钠溶液反应生成碳酸氢钠,离子方程式为CO2+OH-=HCO3-;正确答案:第二周期 ⅣA族;CO2+OH-=HCO3-。
4) D为O元素、E为Na元素、F为Al元素、G为S元素;离子的电子层数越多,则离子半径越大,电子层相同时,离子的核电荷数越大,则离子半径越小,则四种元素对应的离子半径大小为: S2-、O2-、Na+、Al3+;正确答案:S2-、O2-、Na+、Al3+。
(5)金属铝与Na元素的最高价氧化物对应的水化物氢氧化钠反应生成偏铝酸钠和氢气,离子方程式为:2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑;该反应中金属铝做负极,发生氧化反应;因此若将该反应设计成原电池,原电池的负极材料为铝或Al;正确答案:2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑ ; 铝或Al。
(6) 上述元素形成的二元化合物中,能够用于漂白的气体物质为二氧化硫,含有的化学键类型为共价键;具有漂白作用的离子化合物为过氧化钠,属于离子化合物,阴、阳离子个数比为1:2;正确答案:共价键 ; 1:2。
(7) D为O元素,氧原子与氢原子形成的10电子微粒为OH-(X),G元素为S,硫原子与氢原子形成的18电子微粒HS-或H2S(Y),二者发生反应生成盐和水,离子方程式:HS-+OH-=S2-+H2O或H2S+2OH-=S2-+2H2O;正确答案:HS-+OH-=S2-+H2O或H2S+2OH-=S2-+2H2O。


科目:高中化学 来源: 题型:
【题目】硼元素有10B和11B两种同位素,原子百分含量分别为19.7%和80.3%,则硼元素的平均相对原子质量是
A.10.4B.10.6C.10.8D.11.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为 ;
(2)某金属氯化物为MCl29.5g,含有0.200molCl﹣ , 则该氯化物的摩尔质量 , 金属M的相对原子质量为 .
(3)71.5g碳酸钠晶体(Na2CO310H2O)溶于水,配成500ml溶液,此溶液的物质的量浓度为 .
(4)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是 ;密度最小的是 .(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的转化在给定条件下能实现的是( ) ①NH3 ![]() NO2
NO2 ![]() HNO3
HNO3
②SiO2 ![]() Na2SiO3
Na2SiO3 ![]() H2SiO3
H2SiO3
③Mg(OH)2 ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
④Na ![]() Na2O2
Na2O2 ![]() Na2CO3 .
Na2CO3 .
A.②④
B.③④
C.①④
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)水泥是重要的建筑材料.水泥熟料的主要成分为CaO、SiO2 , 并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸.加入硝酸的目的是 , 还可使用代替硝酸.
(2)沉淀A的主要成分是 , 其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 .
(3)加氨水过程中加热的目的是 . 沉淀B的主要成分为、(填化学式).
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4﹣+H++H2C2O4→Mn2++CO2+H2O.实验中称取0.400g水泥样品,滴定时消耗了0.0500molL﹣1的KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是( )
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C. 加稀硝酸酸化后,溶液中无明显变化,再加入AgNO3溶液,生成白色沉淀,能确定有Cl-存在
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂,用最简单的方法鉴别下列物质:①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,正确的鉴别顺序是
A.①②③④B.③④②①C.④①②③D.③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m是X与W形成的化合物,n是Y与W形成的化合物,m、n有如图所示的转化关系,p在常温下为常见的液态化合物,q是W的单质。下列说法不正确的是( )
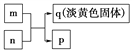
A. 原子半径:Z>W>Y>X
B. 简单氢化物的稳定性:Y>W
C. Z与Y形成的化合物具有两性
D. W的最高价氧化物对应的水化物是一种弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种晶体的晶胞如图所示: 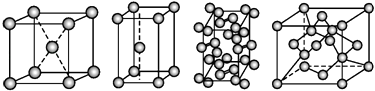
所示晶胞从左到右分别表示的物质正确的排序是( )
A.碘、锌、钠、金刚石
B.金刚石、锌、碘、钠
C.钠、锌、碘、金刚石
D.锌、钠、碘、金刚石
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com