
【题目】几种晶体的晶胞如图所示: 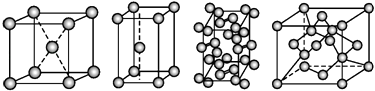
所示晶胞从左到右分别表示的物质正确的排序是( )
A.碘、锌、钠、金刚石
B.金刚石、锌、碘、钠
C.钠、锌、碘、金刚石
D.锌、钠、碘、金刚石
【答案】C
【解析】解:钠属于金属晶体,为体心立方结构,钠原子在晶胞的对角线处相互接触;锌为金属晶体,为密排六方晶格,面心立方晶胞;碘为分子晶体,每个碘分子有两个碘原子,作用力为分子间作用力;金刚石晶胞中有8个C原子处在立方体的顶点、6个处于面心,此外晶胞内部还出现了4个C原子(把晶胞分成8个小立方体的话,这些C处于其中交错的4个的体心),经上分子,第一个图为钠晶体的晶胞结构,第二图为锌晶体的晶胞结构,第三个图为碘晶体的晶胞结构,第四个图为金刚石的晶胞图,故选C.
【考点精析】关于本题考查的离子晶体和原子晶体,需要了解离子间通过离子键结合而成的晶体叫作离子晶体;相邻原子间以共价键相结合而形成空间网状结构的晶体叫原子晶体才能得出正确答案.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________________。
(2)A和D可形成化合物的化学式为________。
(3)B元素在周期表中的位置为_____________;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为________________。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)__________。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为______,若将该反应设计成原电池,原电池的负极材料为___________。
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为____,能够用于漂白的固体物质中阴、阳离子个数比为_________________。
(7)写出D元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组,通过Li3N固体和水反应制取氨气,并进行氨气还原氧化铜的实验探究。如下图所示,给出了本实验可供选择的装置:

请回答下列问题:
(1)按该方法制氨气时,应选用上述装置中的______(填装置代码,下同)做氨气发生装置。写出Li3N和水反应制取氨气的化学方程式____________________。
(2)为检验氨气还原氧化铜反应后生成Cu、H2O、N2,氨气发生装置后应依次连接_____→C→____→_____。(给出的装置可重复使用)
(3)有资料提出:CuO被还原时,当黑色固体完全变为红时,不一定完全转化为Cu,可能还含有Cu2O.已知查阅到一离子反应方程式:Cu2O+2H+═Cu2++Cu+H2O.依据该信息,若要证明C处的红色固体中是否含有Cu2O,请设计实验:_____________________________ 。
(4)甲同学认为利用上述实验设计改进后的装置还可测定Cu的相对原子质量,他是通过测定反应物CuO的质量和生成物H2O的质量来完成的。若实验测得完全反应的CuO和生成的H2O的质量分别为m(CuO)、m(H2O),则据此计算Cu的相对原子为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族化合物的分子式为C7H8O,其中与FeCl3溶液混合显紫色和不显紫色的种类分别为( )
A.2种和1种
B.2种和3种
C.3种和2种
D.3种和1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是 , , , , 同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a . 曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2A(g)2B(g)+E(g)-Q,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压B.减压C.增加E的浓度D.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为1mol/LNaCl溶液、MgCl2溶液、AlCl3三种溶液中,它们的氯离子的物质的量浓度分别是( )
A.1mol/L、1mol/L 、1mol/LB.1mol/L、4mol/L、9mol/L
C.1mol/、2mol/L、1mol/LD.体积未知,无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com