
【题目】下列有关平衡常数的说法正确的是( )
A.已知K=![]() ,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)
,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
B.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小
C.常温下,向纯水中加入碳酸钠,水的电离程度变大,Kw变大
D.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列有关使用的实验仪器及操作等说法正确的是( )
A.在分液实验中,待液体静置分层后,上、下层液体都应分别从分液漏斗下端的活塞放出
B.粗盐提纯中,可先加过量的Na2CO3溶液再加过量的BaCl2溶液来除去Ca2+和SO42-
C.利用蒸发浓缩冷却结晶的方法制备KNO3,对析出的KNO3晶体用酒精洗比用水洗好
D.制取蒸馏水的实验中,球形冷凝管的冷水应从下口进入,上口流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是________________________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于______层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_______________。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是___________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮及其化合物的转化很有意义。下面是氮的氧化物在几种不同情况下的转化:
①已知:2SO2(g)+O2(g)![]() 2SO3(g) H= -196.6 kJmol-1
2SO3(g) H= -196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) H=-113.0kJmol-1
2NO2(g) H=-113.0kJmol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为:______________。
②a.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使其反应达到平衡,正反应速率随时间变化的示意图如图1所示。反应在c点________(“达到”或“未到”)平衡状态。

b.开始时,分别在该容器中加入Ⅰ:2mol SO2(g)和2 mol NO2(g)
Ⅱ:2 mol SO3(g)和2 mol NO(g)。则反应达到平衡时,比较容器Ⅰ和容器Ⅱ中反应平衡常数:Ⅰ____Ⅱ(填“>”“=”或“<”)。 .
(2)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 molL-1,c始(H2O)=1 molL-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是________。此时刻v正________v逆(填“>”或“<”)。 .
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 molL-1,c始(H2O)=1 molL-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是________。此时刻v正________v逆(填“>”或“<”)。 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实:①NaHSO4溶液呈酸性;②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结;③配制CuCl2溶液,用稀盐酸溶解CuCl2固体;④NaHS溶液中c(H2S)>c(S2-);⑤氯化铵溶液可去除金属制品表面的锈斑。其中与盐类的水解有关的叙述有( )
A.6项B.5项C.3项D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaAlO2溶液中滴入NaHCO3溶液:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
B.MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+=Fe3++2H2O
D.Ca(HCO3)2溶液中加入过量氨水:Ca2++HCO3-+NH3·H2O=CaCO3↓+H2O+NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
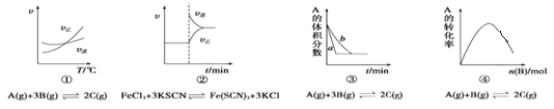
A.①是其他条件一定时,反应速率随温度变化的图像,则逆反应ΔH>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率变化的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。 学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取mg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;发生反应:IO3﹣+5I﹣+6H+=3I2+3H2O,将反应后的溶液加水稀释至100.00 mL。
c.取10.00mL上述溶液到锥形瓶中,以淀粉为指示剂,用物质的量浓度为3.0molL﹣1的 Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32﹣═2I﹣+S4O62﹣)。
d.重复实验2次,三次实验分别记录有关数据如下:
滴定次数 | 待测溶液的体积/mL | 1.00×10﹣3molL﹣1的 Na2S2O3溶液的体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 10.00 | 2.62 | 22.60 |
第二次 | 10.00 | 7.56 | 30.30 |
第三次 | 10.00 | 6.22 | 26.24 |
试回答:
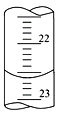
(1)如下图,是某次滴定时的滴定管中的液面,其读数为___________mL。
(2)判断到达滴定终点的现象是:_______________________。
(3)滴定时,Na2S2O3溶液应放在______________ (填“酸式滴定管”或“碱式滴定管”)。
(4)根据实验测定数据,计算加碘食盐样品中的碘元素百分含量是_______(以含m的代数式表示)。
(5)根据上述实验对下列假定情况进行讨论,导致测出待测液的浓度是(填“偏小”、“偏大”或“无影响”)
①标准液读数时,若滴定前俯视,滴定后仰视,测出待测液的浓度__________
②盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,测出待测液的浓度___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com