
ЁОЬтФПЁПЃЈ1ЃЉЕЊМАЦфЛЏКЯЮяЕФзЊЛЏКмгавтвхЁЃЯТУцЪЧЕЊЕФбѕЛЏЮядкМИжжВЛЭЌЧщПіЯТЕФзЊЛЏЃК
ЂйвбжЊЃК2SO2ЃЈgЃЉ+O2ЃЈgЃЉ![]() 2SO3ЃЈgЃЉ H= -196.6 kJmol-1
2SO3ЃЈgЃЉ H= -196.6 kJmol-1
2NOЃЈgЃЉ+O2ЃЈgЃЉ![]() 2NO2ЃЈgЃЉ H=-113.0kJmol-1
2NO2ЃЈgЃЉ H=-113.0kJmol-1
дђSO2ЦјЬхгыNO2ЦјЬхЗДгІЩњГЩSO3ЦјЬхКЭNOЦјЬхЕФШШЛЏбЇЗНГЬЪНЮЊЃК______________ЁЃ
ЂкaЃЎЯђОјШШКуШнУмБеШнЦїжаЭЈШыSO2КЭNO2ЃЌвЛЖЈЬѕМўЯТЪЙЦфЗДгІДяЕНЦНКтЃЌе§ЗДгІЫйТЪЫцЪБМфБфЛЏЕФЪОвтЭМШчЭМ1ЫљЪОЁЃЗДгІдкcЕу________ЃЈЁАДяЕНЁБЛђЁАЮДЕНЁБЃЉЦНКтзДЬЌЁЃ

bЃЎПЊЪМЪБЃЌЗжБ№дкИУШнЦїжаМгШыЂёЃК2mol SO2ЃЈgЃЉКЭ2 mol NO2ЃЈgЃЉ
ЂђЃК2 mol SO3ЃЈgЃЉКЭ2 mol NOЃЈgЃЉЁЃдђЗДгІДяЕНЦНКтЪБЃЌБШНЯШнЦїЂёКЭШнЦїЂђжаЗДгІЦНКтГЃЪ§ЃКЂё____ЂђЃЈЬюЁАЃОЁБЁА=ЁБЛђЁАЃМЁБЃЉЁЃ .
ЃЈ2ЃЉвбжЊдкЮТЖШЮЊTЪБЃЌCOЃЈgЃЉ+H2OЃЈgЃЉ![]() CO2ЃЈgЃЉ+H2ЃЈgЃЉЕФЦНКтГЃЪ§K=0.32ЃЌдкИУЮТЖШЯТЃЌвбжЊcЪМЃЈCOЃЉ=1 molL-1ЃЌcЪМЃЈH2OЃЉ=1 molL-1ЃЌФГЪБПЬОВтЖЈCOЕФзЊЛЏТЪЮЊ10%ЃЌдђИУЗДгІ________ЃЈЬюЁАвбОЁБЛђЁАУЛгаЁБЃЉДяЕНЦНКтЃЌдвђЪЧ________ЁЃДЫЪБПЬvе§________vФцЃЈЬюЁА>ЁБЛђЁА<ЁБЃЉЁЃ .
CO2ЃЈgЃЉ+H2ЃЈgЃЉЕФЦНКтГЃЪ§K=0.32ЃЌдкИУЮТЖШЯТЃЌвбжЊcЪМЃЈCOЃЉ=1 molL-1ЃЌcЪМЃЈH2OЃЉ=1 molL-1ЃЌФГЪБПЬОВтЖЈCOЕФзЊЛЏТЪЮЊ10%ЃЌдђИУЗДгІ________ЃЈЬюЁАвбОЁБЛђЁАУЛгаЁБЃЉДяЕНЦНКтЃЌдвђЪЧ________ЁЃДЫЪБПЬvе§________vФцЃЈЬюЁА>ЁБЛђЁА<ЁБЃЉЁЃ .
ЁОД№АИЁПSO2(g)+NO2(g)![]() NO(g)+SO3 (g)ЃЌЁїH=-41.8kJ/mol ЮДЕН ЃМ УЛга ДЫЪБQc=
NO(g)+SO3 (g)ЃЌЁїH=-41.8kJ/mol ЮДЕН ЃМ УЛга ДЫЪБQc=![]() =0.0123ЃМ0.32 ЃО
=0.0123ЃМ0.32 ЃО
ЁОНтЮіЁП
(1)ЂйвбжЊЃКЂй2SO2(g)+O2(g)![]() 2SO3(g) H= -196.6 kJmol-1ЃЌЂк2NO(g)+O2(g)
2SO3(g) H= -196.6 kJmol-1ЃЌЂк2NO(g)+O2(g)![]() 2NO2(g) H=-113.0kJmol-1ЃЌдђИљОнИЧЫЙЖЈТЩЃЌНЋ
2NO2(g) H=-113.0kJmol-1ЃЌдђИљОнИЧЫЙЖЈТЩЃЌНЋ![]() (Ђй-Ђк)ПЩЕУЃКSO2(g)+NO2(g)
(Ђй-Ђк)ПЩЕУЃКSO2(g)+NO2(g)![]() NO(g)+SO3 (g)ЃЛ
NO(g)+SO3 (g)ЃЛ
ЂкaЃЎЗДгІДяЦНКтЕФИљБОБъжОЪЧVе§=VФцЃЌЖјcЕуЕФжЛЪЧVе§зюДѓЖјвбЃЛ
bЃЎШнЦїКуШнОјШШЃЌSO2(g)+NO2(g)NO(g)+SO3 (g)ЁїHЃМ0ЃЌЗДгІЗХШШЃЌШєдкИУШнЦїжаМгШыЃКЂёЃК1molSO2(g)КЭ1molNO2(g)ЃЌдђПЊЪМЗДгІЗХШШЃЛШєдкШнЦїжаМгШыIIЃК1molSO3(g)КЭ1mol NO(g)ЃЌдђПЊЪМЪБЗДгІЮќШШЃЌОнДЫЗжЮіЦНКтГЃЪ§ЃЛ
(2)вбжЊcЪМ(CO)=1 molL-1ЃЌcЪМ(H2O)=1 molL-1ЃЌФГЪБПЬОВтЖЈCOЕФзЊЛЏТЪЮЊ10%ЃЌдђCOЕФБфЛЏХЈЖШЮЊ0.1mol/LЃЌгЩCO(g)+H2O(g)CO2(g)+H2(g)ПЩжЊЃЌH2OКЭCO2МАH2ЕФБфЛЏХЈЖШОљЮЊ0.1mol/LЃЌдђЦНКтЪБCOЁЂH2OЁЂCO2КЭH2ЕФХЈЖШЗжБ№ЮЊЃК0.9mol/LЁЂ0.9mol/LЁЂ0.1mol/LКЭ0.1mol/LЃЌдйНсКЯQc=![]() ЗжЮіХаЖЯЁЃ
ЗжЮіХаЖЯЁЃ
вдДЫНтД№ИУЬтЁЃ
(1)ЂйвбжЊЃКЂй2SO2(g)+O2(g)![]() 2SO3(g) H= -196.6 kJmol-1ЃЌЂк2NO(g)+O2(g)
2SO3(g) H= -196.6 kJmol-1ЃЌЂк2NO(g)+O2(g)![]() 2NO2(g) H=-113.0kJmol-1ЃЌдђИљОнИЧЫЙЖЈТЩЃЌНЋ
2NO2(g) H=-113.0kJmol-1ЃЌдђИљОнИЧЫЙЖЈТЩЃЌНЋ![]() (Ђй-Ђк)ПЩЕУЃКSO2(g)+NO2(g)
(Ђй-Ђк)ПЩЕУЃКSO2(g)+NO2(g)![]() NO(g)+SO3 (g)ЃЌЁїH=
NO(g)+SO3 (g)ЃЌЁїH=![]() [(-196.6kJmol-1)-(-113.0kJmol-1)]=-41.6kJ/molЃЌЙЪSO2ЦјЬхгыNO2ЦјЬхЗДгІЩњГЩSO3ЦјЬхКЭNOЦјЬхЕФШШЛЏбЇЗНГЬЪНЮЊSO2(g)+NO2(g)
[(-196.6kJmol-1)-(-113.0kJmol-1)]=-41.6kJ/molЃЌЙЪSO2ЦјЬхгыNO2ЦјЬхЗДгІЩњГЩSO3ЦјЬхКЭNOЦјЬхЕФШШЛЏбЇЗНГЬЪНЮЊSO2(g)+NO2(g)![]() NO(g)+SO3 (g)ЃЌЁїH=-41.6kJ/molЃЛ
NO(g)+SO3 (g)ЃЌЁїH=-41.6kJ/molЃЛ
ЂкaЃЎЛЏбЇЦНКтзДЬЌЕФБъжОЪЧИїЮяжЪЕФХЈЖШВЛдйИФБфЃЌЦфЪЕжЪЪЧе§ЗДгІЫйТЪЕШгкФцЗДгІЫйТЪЃЌc/span>ЕуЖдгІЕФе§ЗДгІЫйТЪЯдШЛЛЙдкИФБфЃЌЙЪвЛЖЈЮДДяЦНКтЃЛ
bЃЎШнЦїКуШнОјШШЃЌSO2(g)+NO2(g)NO(g)+SO3 (g)ЁїHЃМ0ЃЌЗДгІЗХШШЃЌШєдкИУШнЦїжаМгШыЃКЂёЃК1molSO2(g)КЭ1molNO2(g)ЃЌдђПЊЪМЗДгІЗХШШЃЌЮТЖШЩ§ИпЦНКтзѓвЦЃЌKМѕаЁЃЛШєдкШнЦїжаМгШыIIЃК1molSO3(g)КЭ1mol NO(g)ЃЌдђПЊЪМЪБЗДгІЮќШШЃЌЮТЖШНЕЕЭЦНКтгввЦЃЌKдіДѓЃЌЙЪИУЗДгІЕФЦНКтГЃЪ§ЂёЃМЂђЃЛ
(2)вбжЊcЪМ(CO)=1 molL-1ЃЌcЪМ(H2O)=1 molL-1ЃЌФГЪБПЬОВтЖЈCOЕФзЊЛЏТЪЮЊ10%ЃЌдђCOЕФБфЛЏХЈЖШЮЊ0.1mol/LЃЌгЩCO(g)+H2O(g)CO2(g)+H2(g)ПЩжЊЃЌH2OКЭCO2МАH2ЕФБфЛЏХЈЖШОљЮЊ0.1mol/LЃЌдђЦНКтЪБCOЁЂH2OЁЂCO2КЭH2ЕФХЈЖШЗжБ№ЮЊЃК0.9mol/LЁЂ0.9mol/LЁЂ0.1mol/LКЭ0.1mol/LЃЌДЫЪБQc=![]() =0.0123ЃМ0.32ЃЌдђУЛгаДяЕНЦНКтзДЬЌЃЌЗДгІЯђе§ЗДгІЗНЯђвЦЖЏЃЌvе§ЃОvФцЁЃ
=0.0123ЃМ0.32ЃЌдђУЛгаДяЕНЦНКтзДЬЌЃЌЗДгІЯђе§ЗДгІЗНЯђвЦЖЏЃЌvе§ЃОvФцЁЃ


 аЁбЇНЬВФЭъШЋНтЖСЯЕСаД№АИ
аЁбЇНЬВФЭъШЋНтЖСЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙшЭщЪЧвЛжжЮоЩЋЁЂгыПеЦјЗДгІВЂЛсв§Ц№жЯЯЂЕФЦјЬхЃЎЦфЗжзгНсЙЙКЭ![]() ЯрЫЦЃЌЕЋ
ЯрЫЦЃЌЕЋ![]() МќМќФмБШ
МќМќФмБШ![]() МќМќФмЕЭЁЃЯТСаХаЖЯДэЮѓЕФЪЧ
МќМќФмЕЭЁЃЯТСаХаЖЯДэЮѓЕФЪЧ
A.![]() ЗжзгГЪе§ЫФУцЬхаЮ
ЗжзгГЪе§ЫФУцЬхаЮ
B.![]() ЗжзгЪЧЗЧМЋадЗжзг
ЗжзгЪЧЗЧМЋадЗжзг
C.вђЮЊ![]() МќМќФмБШ
МќМќФмБШ![]() МќМќФмЕЭЃЌЫљвд
МќМќФмЕЭЃЌЫљвд![]() ЗаЕуЕЭгк
ЗаЕуЕЭгк![]() ЗаЕу
ЗаЕу
D.![]() ЗжзгЮШЖЈадЕЭгк
ЗжзгЮШЖЈадЕЭгк![]() ЗжзгЃЌвђЮЊ
ЗжзгЃЌвђЮЊ![]() МќМќФмИп
МќМќФмИп
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФПЧАПЦбЇМве§дкбаОПКЭЭъЩЦвЛжжвдЦЯЬбЬЧЃЈC6H12O6ЃЉЮЊШМСЯЕФЮЂЩњЮяЫсадШМСЯЕчГиЃЌЦфНсЙЙШчЭМЫљЪОЁЃИУЕчГиЙЄзїЪБгаЙиЫЕЗЈе§ШЗЕФЪЧ
A.УПЯћКФ1 mol O2ЃЌРэТлЩЯФмЩњГЩБъзМзДПіЯТCO2ЦјЬх22.4L
B.NЕчМЋЮЊИУЕчГиЕФе§МЋЃЌMМЋЩЯЗЂЩњбѕЛЏЗДгІ
C.HЃЋНЋЛсДгMМЋЧјЯђNМЋЧјЧЈвЦ
D.ЮТЖШдНИпЙЉЕчаЇЙћдНКУ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
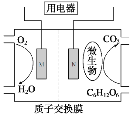
ЁОЬтФПЁПвбжЊAЕФВњСПЭЈГЃгУРДКтСПвЛИіЙњМвЕФЪЏгЭЛЏЙЄЫЎЦНЃЌЯжвдAЮЊжївЊдСЯКЯГЩвЛжжОпгаЙћЯуЮЖЕФЮяжЪEЃЌЦфКЯГЩТЗЯпШчЯТЭМЫљЪОЁЃ
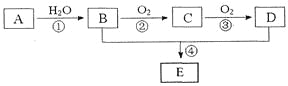
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉBЁЂDЗжзгжаЕФЙйФмЭХУћГЦЗжБ№ЪЧ__________ЁЂ__________ЁЃ
ЃЈ2ЃЉаДГіЯТСаЗДгІЕФЛЏбЇЗНГЬЪНЃЌВЂзЂУїЗДгІРраЭЃК
Ђк____________________ЃЌ___________ЃЛЂм____________________ЃЌ___________ЁЃ
ЃЈ3ЃЉдкЪЕбщЪвРћгУBКЭDжЦБИEЕФЪЕбщжаЃЌШєгУ1mol BКЭ1 mol DГфЗжЗДгІЃЌФмЗёЩњГЩ1mol E_________ЃЌдвђЪЧ__________ЁЃ
ЃЈ4ЃЉШє184g BКЭ120g DЗДгІФмЩњГЩ106g EЃЌдђИУЗДгІЕФВњТЪ______________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкУмБеШнЦїжавЛЖЈСПЛьКЯЦјЬхЗЂЩњЗДгІЃК2A(g)+B(g)![]() xC(g)ЃЌДяЕНЦНКтЪБВтЕУAЕФХЈЖШЮЊ0.5mol/LЃЌдкЮТЖШВЛБфЕФЬѕМўЯТЃЌНЋШнЦїжаЕФШнЛ§РЉДѓЕНдРД2БЖЃЌдйДяЦНКтЪБЃЌВтЕУAЕФХЈЖШЮЊ0.3mol/LЃЌЯТСагаЙиХаЖЯе§ШЗЕФЪЧ
xC(g)ЃЌДяЕНЦНКтЪБВтЕУAЕФХЈЖШЮЊ0.5mol/LЃЌдкЮТЖШВЛБфЕФЬѕМўЯТЃЌНЋШнЦїжаЕФШнЛ§РЉДѓЕНдРД2БЖЃЌдйДяЦНКтЪБЃЌВтЕУAЕФХЈЖШЮЊ0.3mol/LЃЌЯТСагаЙиХаЖЯе§ШЗЕФЪЧ
A. x=3 B. ЦНКтЯђе§ЗДгІЗНЯђвЦЖЏ
C. BЕФзЊЛЏТЪНЕЕЭ D. CЕФЬхЛ§ЗжЪ§діДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЃЌЯђ20 mL0.1 mol/L H2AШмвКжаж№ЕЮМгШы0.1 mol/L NaOHШмвКЃЌH2AШмвКжаИїСЃзгХЈЖШЗжЪ§ІФ(X)ЫцШмвКpHБфЛЏЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ ( )

A.ЕБШмвКжаAдЊЫиЕФжївЊДцдкаЮЬЌЮЊA2-ЪБЃЌШмвКПЩФмЮЊШѕЫсадЁЂжаадЛђМюад
B.ЕБМгШыNaOHШмвКжС20 mLЪБЃЌШмвКжаДцдк((Na+)=2c(A2-)+c(HA-)
C.ЪвЮТЯТЃЌЗДгІA2-+H2A=2HA-ЕФЦНКтГЃЪ§ЕФЖдЪ§жЕlgK=3
D.ЪвЮТЯТЃЌШѕЫсH2AЕФЕквЛМЖЕчРыЦНКтГЃЪ§гУKa1БэЪОЃЌNa2AЕФЕкЖўМЖЫЎНтЦНКтГЃЪ§гУKh2БэЪОЃЌдђKal>Kh2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЦНКтГЃЪ§ЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.вбжЊK=![]() ЃЌдђЖдгІЕФЛЏбЇЗДгІПЩвдБэЪОЮЊЃК2CO2(g) + 6H2(g)
ЃЌдђЖдгІЕФЛЏбЇЗДгІПЩвдБэЪОЮЊЃК2CO2(g) + 6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
B.ЛЏбЇЦНКтГЃЪ§KгыЮТЖШгаЙиЃЌЫцЮТЖШЕФЩ§ИпЃЌKПЩФмдіДѓвВПЩФмМѕаЁ
C.ГЃЮТЯТЃЌЯђДПЫЎжаМгШыЬМЫсФЦЃЌЫЎЕФЕчРыГЬЖШБфДѓЃЌKwБфДѓ
D.НЋФГХЈЖШЧтЗњЫсШмвКЩ§ИпЮТЖШЃЌЧтЗњЫсЕФЕчРыЦНКтГЃЪ§KaНЋБфДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПI.дквЛЖЈЬхЛ§ЕФУмБеШнЦїжаЃЌНјааШчЯТЛЏбЇЗДгІЃКCO2(g)ЃЋH2(g)![]() CO(g)ЃЋH2O(g)ЃЌЦфЛЏбЇЦНКтГЃЪ§KКЭЮТЖШTЕФЙиЯЕШчЯТБэЃЌЛиД№ЯТСаЮЪЬтЃК
CO(g)ЃЋH2O(g)ЃЌЦфЛЏбЇЦНКтГЃЪ§KКЭЮТЖШTЕФЙиЯЕШчЯТБэЃЌЛиД№ЯТСаЮЪЬтЃК
tЁц | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
ЃЈ1ЃЉИУЗДгІЕФЛЏбЇЦНКтГЃЪ§БэДяЪНЮЊKЃН___ЁЃ
ЃЈ2ЃЉИУЗДгІЮЊ___ЗДгІ(бЁЬюЮќШШЁЂЗХШШ)ЁЃ
ЃЈ3ЃЉФГЮТЖШЯТЃЌЦНКтХЈЖШЗћКЯЯТЪНЃКc(CO2)ЁЄc(H2)ЃНc(CO)ЁЄc(H2O)ЃЌЪдХаЖЯДЫЪБЕФЮТЖШЮЊ___KЁЃ
II.НЋЦјЬхAЁЂBжУгкЙЬЖЈШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌЗЂЩњШчЯТЗДгІЃК3A(g)ЃЋB(g)![]() 2C(g)ЃЋ2D(g)ЃЌЗДгІНјааЕН10sФЉЃЌДяЕНЦНКтЃЌВтЕУAЕФЮяжЪЕФСПЮЊ1.8molЃЌBЕФЮяжЪЕФСПЮЊ0.6molЃЌCЕФЮяжЪЕФСПЮЊ0.8molЁЃ
2C(g)ЃЋ2D(g)ЃЌЗДгІНјааЕН10sФЉЃЌДяЕНЦНКтЃЌВтЕУAЕФЮяжЪЕФСПЮЊ1.8molЃЌBЕФЮяжЪЕФСПЮЊ0.6molЃЌCЕФЮяжЪЕФСПЮЊ0.8molЁЃ
ЃЈ1ЃЉгУCБэЪО10sФкЗДгІЕФЦНОљЗДгІЫйТЪЮЊ___ЁЃ
ЃЈ2ЃЉЗДгІЧАAЕФЮяжЪЕФСПХЈЖШЪЧ___ЁЃ
ЃЈ3ЃЉ10sФЉЃЌЩњГЩЮяDЕФХЈЖШЮЊ____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИїПЩФцЗДгІДяЦНКтКѓЃЌИФБфЗДгІЬѕМўЃЌЦфБфЛЏЧїЪЦе§ШЗЕФЪЧ
A. B.
B.
C. D.
D.
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com