
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,___________;④____________________,___________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E_________,原因是__________。
(4)若184g B和120g D反应能生成106g E,则该反应的产率______________________。
【答案】羟基 羧基 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3COOH+CH3CH2OH
2CH3CHO+2H2O 氧化反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 取代反应(酯化反应) 不能 该反应为可逆反应,有一定的限度,不可能完全转化 60.2%
CH3COOCH2CH3+H2O 取代反应(酯化反应) 不能 该反应为可逆反应,有一定的限度,不可能完全转化 60.2%
【解析】
由于A的产量通常用来衡量一个国家的石油化工水平,所以A是乙烯C2H4;乙烯与水发生加成反应产生B:乙醇CH3CH2OH;乙醇催化氧化得到C:乙醛CH3CHO;乙醛催化氧化得到D:乙酸CH3COOH;乙醇与乙酸在浓硫酸作用下发生酯化反应得到E:乙酸乙酯CH3COOCH2CH3和水。
(1)B、D分子中的官能团名称分别是羟基、羧基;
(2)②反应的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应类型是氧化反应;④反应的化学方程式是CH3COOH+CH3CH2OH
2CH3CHO+2H2O,反应类型是氧化反应;④反应的化学方程式是CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,反应类型是取代反应(也叫酯化反应);
CH3COOCH2CH3+H2O,反应类型是取代反应(也叫酯化反应);
(3)由于酯化反应与酯的水解反应互为可逆反应,所以在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,不能生成1mol E;
(4)184g乙醇的物质的量是![]() =4mol; 120g乙酸的物质的量是
=4mol; 120g乙酸的物质的量是![]() =2mol,由于乙醇过量,所以反应产生的乙酸乙酯应该按照乙酸来计算,理论上应该产生乙酸乙酯的质量是2mol×88g/mol=196g,实际反应能生成106g E,则该反应的产率
=2mol,由于乙醇过量,所以反应产生的乙酸乙酯应该按照乙酸来计算,理论上应该产生乙酸乙酯的质量是2mol×88g/mol=196g,实际反应能生成106g E,则该反应的产率![]() ×100%=60.2%。
×100%=60.2%。


科目:高中化学 来源: 题型:
【题目】按要求答题:
(1)金属焊接时可用NH4Cl溶液作除锈剂的原因(用离子方程式回答)_____________________________。
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=_____________mol·L-1(填精确值)。
(3)常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为_______________________(用含代数a、b等表示)。
(4)常温,PH=5 的H2SO4溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中c(H+):c(SO42-)=________
(5)已知:H2CO3的电离平衡常数 K1=4.4×10-7 ; K2=4.7×10-11,HClO的电离平衡常数K=3.0×10-8,则将少量CO2气体通入NaClO溶液中的离子方程式____________________
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应 X(g)+3Y(g)![]() 2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
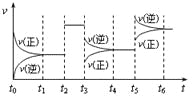
A. t2时加入了催化剂
B. t3时减小了体系压强
C. t5时升高了体系温度
D. t2、t3、t5变化后反应物转化率均比t1时减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。

已知:i. 
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________

(8)合成8羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其元素特征信息如下表
元素 | 元素特征信息 |
A | 其单质是密度最小的物质。 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一。 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物。 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)写出下列元素的名称:C___________,E______________
(2)写出A、B、C形成的化合物的电子式____________________
(3)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)____________________
(4)写出E单质与A、B、C形成的化合物反应的化学方程式:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图中四个图像的说法正确的是


注:图中,E表示能量,p表示压强,t表示时间,V表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=+183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g)![]() 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1 molL-1的硫酸铜溶液,正确的操作是( )
A. 称取25 g胆矾,溶解在1 L水里
B. 称取25 g胆矾溶于水,然后将此溶液稀释至1L
C. 将16 g胆矾溶于水,然后将此溶液稀释至1L
D. 将胆矾加热除去结晶水后,称取16 g溶解在1L水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:
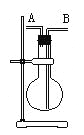
① H2②Cl2③CH4④HCl ⑤NH3⑥NO ⑦NO2⑧SO2,
下列操作正确的是
A. 烧瓶是干燥的,由A进气收集①③⑤
B. 烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C. 在烧瓶中充满水,由A进气收集①③⑤⑦
D. 在烧瓶中充满水,由B进气收集⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中的W、X、Y、Z均为短周期元素,其原子最外层电子数之和为22。下列说法不正确的是( )
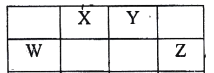
A.以上元素都可以与H元素形成18电子的分子
B.X的氧化物都不是酸性氧化物
C.Y与金属钠形成的化合物可能含有非极性共价键
D.1mol W的单质与足量的Z的单质反应,转移电子数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com