
【题目】使用胆矾(CuSO45H2O)配制0.1 molL-1的硫酸铜溶液,正确的操作是( )
A. 称取25 g胆矾,溶解在1 L水里
B. 称取25 g胆矾溶于水,然后将此溶液稀释至1L
C. 将16 g胆矾溶于水,然后将此溶液稀释至1L
D. 将胆矾加热除去结晶水后,称取16 g溶解在1L水中
【答案】B
【解析】
A.25 g胆矾的物质的量为![]() =0.1mol,含有硫酸铜0.1mol,溶解在1 L水里,溶液的体积大于1L,所得溶液物质的量浓度小于0.1mol/L,故A错误;
=0.1mol,含有硫酸铜0.1mol,溶解在1 L水里,溶液的体积大于1L,所得溶液物质的量浓度小于0.1mol/L,故A错误;
B.25 g胆矾的物质的量为0.1mol,含有硫酸铜0.1mol,溶于水,然后将此溶液稀释至1 L,溶液体积为1L,所以溶液的物质的量浓度为0.1mol/L,故B正确;
C.16 g胆矾物质的量小于0.1mol,含有的硫酸铜物质的量小于0.1mol,溶于水,然后将此溶液稀释至1 L,所得溶液的浓度小于0.1mol/L,故C错误;
D.16g硫酸铜的物质的量为![]() =0.1mol,溶解在1 L水里,溶液的体积大于1L,所得溶液物质的量浓度小于0.1mol/L,故D错误;
=0.1mol,溶解在1 L水里,溶液的体积大于1L,所得溶液物质的量浓度小于0.1mol/L,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:_______。
②最外层电子数等于次外层电子数的元素原子:______。
(2)现有粒子:1H、35Cl、2H、14N、2H37Cl,其中:
①有_________种元素;
②__________之间互称同位素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
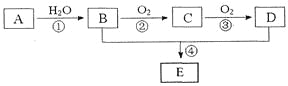
请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,___________;④____________________,___________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E_________,原因是__________。
(4)若184g B和120g D反应能生成106g E,则该反应的产率______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-===2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+===Mn2++I2+3H2O、I2+2S2O32-===2I-+S4O62-。
试回答:
(1)滴定操作时,左手控制滴定管,右手_________________,眼睛要注视__________________________。
(2)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液颜色变化为_________________。
(3)水中溶解氧的计算式是_______________(以g/L为单位)。
(4)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果________(填“偏高”“偏低”或“无影响”,下同)。
(5)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A.Al2O3+6HCl=2AlCl3+3H2O
B.Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
C.2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D.SiO2+2NaOH=Na2SiO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1) 同温同压下,同体积的NH3和H2S气体的质量比是________________;同质量的NH3和H2S气体的体积比是_____________,同质量的NH3和H2S气体中所含氢原子个数比是_____________,若两者所含氢原子个数相等,它们的物质的量比是__________;
(2)在100ml Al2(SO4)3溶液中含0.6molSO42-,从中取出1/4 体积的该溶液再稀释到100 ml,则稀释后的溶液中SO42-的物质的量浓度为_______________。。
(3)在氯化镁和硫酸镁的混合液中,若Mg2+与Cl-的物质的量浓度之比为4∶3时,则Mg2+与SO42-物质的量浓度之比为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com