
【题目】1000 ml某无色待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、CO32-、HCO3-、SO42- |
现进行如下实验操作(所加试剂均过量):(已知:NH4+ + OH- (浓)= NH3↑ +H2O)
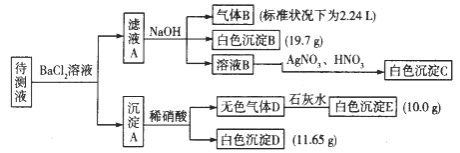
(1)原溶液中肯定存在的离子是(除Na+) ,肯定不存在的离子是 。
(2)写出生成白色沉淀B的离子方程式: 。写出沉淀A溶于稀硝酸的离子方程式:_____________________。
(3)将滤液A和沉淀A分开的操作是过滤,洗涤。洗涤的操作是 。
【答案】
(1)CO32-、HCO3-、SO42-K+、NH4+;Fe3+、Ba2+;
(2)HCO3-+OH-+Ba2+=BaCO3↓+H2O;BaCO3+2H+=Ba2++H2O+CO2↑;
(3)沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次。
【解析】
试题分析:待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(1)由上述分析可知,不能确定原溶液中是否含有Cl-,若无色气体D是单一气体,则D为CO2,E为CaCO3,溶液中含有CO32-,白色沉淀D只能为BaSO4,溶液中一定含有SO42-,B(碳酸钡)的物质的量=![]() =0.1mol,则n(HCO3-)=0.1mol,故c(HCO3-)=
=0.1mol,则n(HCO3-)=0.1mol,故c(HCO3-)=![]() =0.1mol/L, E(碳酸钙)的物质的量=
=0.1mol/L, E(碳酸钙)的物质的量=![]() =0.1mol,则n(CO32-)=0.1mol,故c(CO32-)=
=0.1mol,则n(CO32-)=0.1mol,故c(CO32-)=![]() =0.1mol/L,D(硫酸钡)的物质的量=
=0.1mol/L,D(硫酸钡)的物质的量=![]() =0.05mol,则n(SO42-)=0.05mol,故c(SO42-)=
=0.05mol,则n(SO42-)=0.05mol,故c(SO42-)=![]() =0.05mol/L,n(NH4+)=n(NH3)=
=0.05mol/L,n(NH4+)=n(NH3)=![]() =0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,原溶液中肯定存在的离子有CO32-、HCO3-、SO42- K+、NH4+,肯定不存在的离子有Fe3+、Ba2+,故答案为:CO32-、HCO3-、SO42- K+、NH4+;Fe3+、Ba2+;
=0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,原溶液中肯定存在的离子有CO32-、HCO3-、SO42- K+、NH4+,肯定不存在的离子有Fe3+、Ba2+,故答案为:CO32-、HCO3-、SO42- K+、NH4+;Fe3+、Ba2+;
(2)生成白色沉淀B的离子方程式为HCO3-+OH-+ Ba2+ = BaCO3↓+H2O,沉淀A溶于稀硝酸的离子方程式为BaCO3+2H+=Ba2+ +H2O+CO2↑,故答案为:HCO3-+OH-+ Ba2+ = BaCO3↓+H2O;BaCO3+2H+=Ba2+ +H2O+CO2↑;
(3)洗涤的操作是沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次,故答案为:沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次。


科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中能大量共存的是
A. 在含有大量HCO3―的溶液中:K+、Na+、Al3+、Br-
B. 使pH试纸变蓝的溶液中:NH4+、Na+、Cl-、ClO-
C. 含有0.1 mol·L-1 Br—离子的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D. 能使甲基橙变红的溶液中:Na+、K+、SO2-4、AlO-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
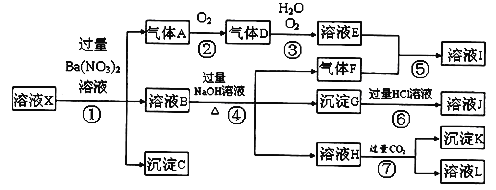
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有:
(2)溶液X中,关于NO3ˉ的判断一定正确的是;
a.一定有
B.一定没有
C.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,
⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是

A.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
B.V1∶V2=l∶5
C.M点时生成的CO2为0.05mol
D.a曲线表示的离子方程式为AlO2-+H++H2O==Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是( )
。下列有关物质的推断不正确的是( )
A. 若甲为AlCl3溶液,则丁可能是NaOH溶液资
B. 若甲为氮气,则丁可能是O2
C. 若甲为Fe,则丁可能是稀硝酸
D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)向某密闭容器中加入0 .3 molA 、0 .1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是 ( )
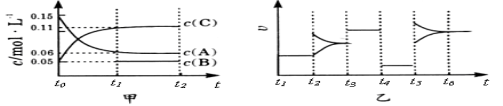
A.若t1=15 s,生成物C在t0~t1时间段的平均反应速率为0.004mol·L-1·s-1
B.t4~t5阶段改变的条件为降低反应温度
C.B的起始物质的量为 0.02mol
D.t5~t6阶段容器内A的物质的量减少0.03 mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)![]() B(g)+2C(g) ΔH=+100akJ·mol-1
B(g)+2C(g) ΔH=+100akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫原子的质量是ag,12C原子的质量是bg,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ②mg该硫原子的物质的量为
②mg该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNA g ④ag该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com