
【题目】(双选)向某密闭容器中加入0 .3 molA 、0 .1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是 ( )
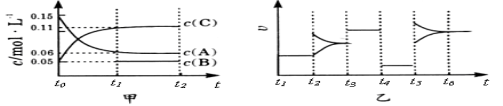
A.若t1=15 s,生成物C在t0~t1时间段的平均反应速率为0.004mol·L-1·s-1
B.t4~t5阶段改变的条件为降低反应温度
C.B的起始物质的量为 0.02mol
D.t5~t6阶段容器内A的物质的量减少0.03 mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)![]() B(g)+2C(g) ΔH=+100akJ·mol-1
B(g)+2C(g) ΔH=+100akJ·mol-1
【答案】AD
【解析】
试题分析:A、根据化学反应速率的定义,v(C)=(0.11-0.05)/15mol/(L·s)=0.004 mol/(L·s),故正确;B、降低温度,正逆反应速率都降低,任何反应都会伴随能量变化,降低温度,平衡必然移动,故错误;C、使用催化剂,加快反应速率,因此t4时刻,降低压强,但平衡不移动,说明反应前后气体系数之和不变,根据甲图像,v(C):v(A)=0.06:0.09=2:3,即B的系数为1,反应方程式为:3A![]() B+2C因此B的起始物质的量为0.04mol,故错误;D、t5~t6,A的物质的量减少,说明反应向正反应方向移动,t5时刻升高温度,根据勒夏特列原理,正反应方向为吸热反应,因此热化学反应方程式为3A(g)
B+2C因此B的起始物质的量为0.04mol,故错误;D、t5~t6,A的物质的量减少,说明反应向正反应方向移动,t5时刻升高温度,根据勒夏特列原理,正反应方向为吸热反应,因此热化学反应方程式为3A(g) ![]() B(g)+2C(g) △H=+100akJ·mol-1,故正确。
B(g)+2C(g) △H=+100akJ·mol-1,故正确。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】在120℃、1个大气压下,将150mLCH4和He的混合气体中与350mLO2混合,点燃并充分反应。
(1)若恢复到原条件,则混合气体的总体积为mL
(2)若再将以上混合气体干燥,得混合气体450mL。则原混合气体中CH4和He的体积比为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个脱落标签的试剂瓶中,分别盛有盐酸、Ba(OH)2溶液、NaHCO3溶液、Mg(NO3)2溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为A+B混合产生无色气体;B+C混合产生白色沉淀;C+D混合产生白色沉淀;A+C混合无明显变化。
(1)A+C反应的离子方程式为 。
(2)A+B反应的离子方程式为 。
(3) C +D反应的离子方程式为 。
(4)少量B+C反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1000 ml某无色待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、CO32-、HCO3-、SO42- |
现进行如下实验操作(所加试剂均过量):(已知:NH4+ + OH- (浓)= NH3↑ +H2O)
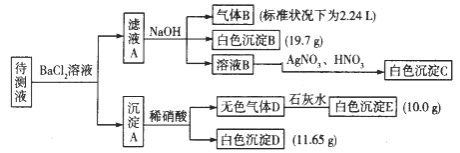
(1)原溶液中肯定存在的离子是(除Na+) ,肯定不存在的离子是 。
(2)写出生成白色沉淀B的离子方程式: 。写出沉淀A溶于稀硝酸的离子方程式:_____________________。
(3)将滤液A和沉淀A分开的操作是过滤,洗涤。洗涤的操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)往一个体积不变的密闭容器中充入H2和I2发生反应H2(g)+I2(g)![]() 2HI(g) △H>0,当达到平衡后,t0时改变某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是( )
2HI(g) △H>0,当达到平衡后,t0时改变某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是( )

A.容器内气体颜色变浅,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2的转化率增大,HI平衡浓度变小
D.改变条件前后,速率图象如图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与材料、生活和环境密切相关。下列有关说法中错误的是( )
A.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
B.医疗中常用酒精溶液来消毒,是因为酒精溶液能够使细菌蛋白发生变性
C.大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D.新型材料聚酯纤维、光导纤维都属于有机高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A. 有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B. 工业上通过电解氯化钠溶液制备金属钠和氯气
C. 室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④
B.①②③
C.②③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1L lmol·L—1FeBr2溶液与l molCl2气反应时转移的电子数目为3NA
B. 7g分子式为CnH2n的链烃中含有的C—H键的数目为NA
C. 常温时,1.0L pH=13的Ba(OH)2溶液中含有OH—的数目为0.2NA
D. 0.5mol·L—1硫酸钠溶液中含有溶质离子总数为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com