
【题目】在四个脱落标签的试剂瓶中,分别盛有盐酸、Ba(OH)2溶液、NaHCO3溶液、Mg(NO3)2溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为A+B混合产生无色气体;B+C混合产生白色沉淀;C+D混合产生白色沉淀;A+C混合无明显变化。
(1)A+C反应的离子方程式为 。
(2)A+B反应的离子方程式为 。
(3) C +D反应的离子方程式为 。
(4)少量B+C反应的离子方程式为 。
【答案】(1)H++OH-=H2O
(2)HCO3-+H+=CO2↑+H2O
(3)Mg2++2OH-=Mg(OH)2↓
(4)HCO3-+OH-+Ba2+=H2O+BaCO3↓
【解析】
试题分析:由物质的性质、复分解反应发生的条件可知,盐酸与NaHCO3溶液混合产生无色气体,NaHCO3溶液与Ba(OH)2溶液混合能产生白色沉淀,Ba(OH)2溶液与Mg(NO3)2溶液混合产生白色沉淀,盐酸与Ba(OH)2溶液混合无明显变化,则A、B、C、D分别是盐酸、NaHCO3溶液、Ba(OH)2溶液、Mg(NO3)2溶液;(1)2HCl + Ba(OH)2 = BaCl2 + 2H2O,将易溶且完全电离的HCl、Ba(OH)2、BaCl2 拆写成离子形式可得:2H++2Cl-+Ba2++2OH-=Ba2++2Cl-+2H2O,删去2Cl-、Ba2+可得:2H++2OH-=2H2O,最后将系数约为最简整数比可得:H++OH- = H2O;
(2)HCl+NaHCO3=NaCl+H2O+CO2↑,将易溶且完全电离的HCl、NaHCO3、NaCl拆写成离子形式可得:H++Cl-+Na++HCO3-=Na++Cl-+H2O+CO2↑,删去Cl-、Na+可得:H++HCO3-=H2O+CO2↑(注意不能完全电离,因此不能拆写为H+和CO32-);
(3)Ba(OH)2+Mg(NO3)2=Ba(NO3)2+Mg(OH)2↓,将易溶且完全电离的Ba(OH)2、Mg(NO3)2、Ba(NO3)2拆写成离子形式可得:Ba2 + + 2OH- + Mg2 + + 2NO3- = Ba2 + + 2NO3- + Mg(OH)2↓,删去Ba2 + 、2NO3-可得:Mg2 + + 2 OH- = Mg(OH)2↓;
(4)由以少定多法、先中和后沉淀法可知,设NaHCO3的系数为1,配平可得:1NaHCO3 + 1Ba(OH)2 = H2O + BaCO3↓ + NaOH,将易溶且完全电离的NaHCO3、Ba(OH)2、NaOH拆写成离子形式可得:Na + + HCO3- + Ba2 + + 2OH- = H2O + BaCO3↓ + Na + + OH-,删去Na + 、OH-可得:HCO![]() +OH- + Ba2 + = H2O + BaCO3↓。
+OH- + Ba2 + = H2O + BaCO3↓。


科目:高中化学 来源: 题型:
【题目】下列说法或表达正确的是
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②向100mL0.1mol/L的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
③因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:IO3-+5I-+3H2O=3I2+6OH-
⑤碳酸氢根离子的电离方程式可表示为:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
A.全部
B.②⑤
C.②③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
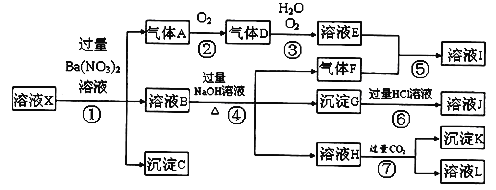
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有:
(2)溶液X中,关于NO3ˉ的判断一定正确的是;
a.一定有
B.一定没有
C.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,
⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合溶液中K+、Al3+、SO42-的浓度分别为0.1mol/L、0.1mol/L和0.2mol/L,则所取K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比是(忽略混合后体积变化)
A.1:1:1 B.2:1:1 C.1:1:2 D.2:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是

A.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
B.V1∶V2=l∶5
C.M点时生成的CO2为0.05mol
D.a曲线表示的离子方程式为AlO2-+H++H2O==Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)向某密闭容器中加入0 .3 molA 、0 .1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是 ( )
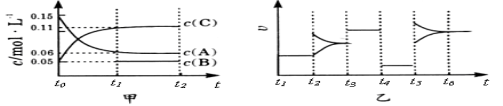
A.若t1=15 s,生成物C在t0~t1时间段的平均反应速率为0.004mol·L-1·s-1
B.t4~t5阶段改变的条件为降低反应温度
C.B的起始物质的量为 0.02mol
D.t5~t6阶段容器内A的物质的量减少0.03 mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)![]() B(g)+2C(g) ΔH=+100akJ·mol-1
B(g)+2C(g) ΔH=+100akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH增大
C. 滴加新制氯水,平衡向左移动,溶液pH减小
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com