
【题目】下列说法或表达正确的是
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②向100mL0.1mol/L的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
③因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:IO3-+5I-+3H2O=3I2+6OH-
⑤碳酸氢根离子的电离方程式可表示为:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
A.全部
B.②⑤
C.②③④
D.②④
【答案】B
【解析】
试题分析:①HClO有强氧化性而具有漂白性,SO2和有色物质发生化合反应而漂白,活性炭具有吸附性,则漂白原理不同,①错误;②亚铁离子的还原性强于溴离子,氯气首先氧化亚铁离子,向100mL0.1mol/L的溴化亚铁即含有0.01mol溴化亚铁的溶液中通入0.05mol的氯气时氯气过量,因此发生反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,②正确;③非金属性Cl>S,可比较最高价含氧酸的酸性,不能比较HClO、稀H2SO4的氧化性,二者没有因果关系,③错误;④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式为IO3-+5I-+6H+=3I2+3H2O,④错误;⑤碳酸氢根离子电离产生氢离子,电离方程式:HCO3-+H2O![]() H3O++CO32-,⑤正确;⑥从上到下,卤族元素的非金属性逐渐减弱,气态氢化物的稳定性减弱,其水溶液中氢卤酸的酸性依次增强,⑥错误;答案选B。
H3O++CO32-,⑤正确;⑥从上到下,卤族元素的非金属性逐渐减弱,气态氢化物的稳定性减弱,其水溶液中氢卤酸的酸性依次增强,⑥错误;答案选B。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,下列各组热化学方程式中,△H1<△H2是( )
A.C(s)+![]() O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
B.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g); △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
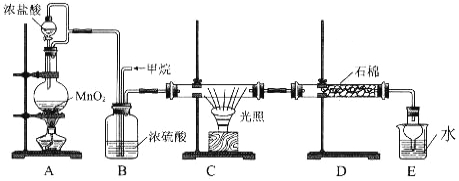
(1)A 中制取 C12 反应的离子方程式是 。
(2)B 装置中浓硫酸的作用是 。
(3)D 装置中的石棉上吸附着潮湿的 KI 粉末,其作用是 。
(4)E 装置的作用是 (填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E 装置中除了有盐酸生成外,还含有有机物,从 E 中分离出盐酸的最佳方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)===CO(g) ΔH=-393.5 kJ/mol
O2(g)===CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》。下列做法有利于该目标实现的是( )
A.推广使用含磷洗涤剂
B.用O3替代Cl2作饮用水消毒剂
C.用工业污水直接灌溉农田
D.含H2SO4的废水用BaCl2处理后排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3 kJ。
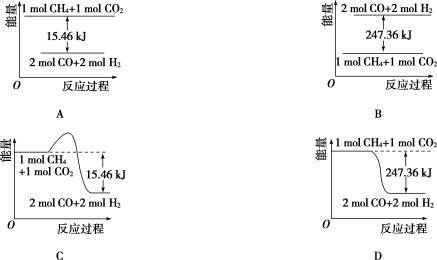
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。
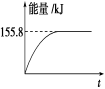
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为_________________。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=______________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是______________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A.Ag和AgCl溶液 B.Ag和AgNO3溶液
C.Pt和Ag2CO3溶液 D.Pt和Ag2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、1个大气压下,将150mLCH4和He的混合气体中与350mLO2混合,点燃并充分反应。
(1)若恢复到原条件,则混合气体的总体积为mL
(2)若再将以上混合气体干燥,得混合气体450mL。则原混合气体中CH4和He的体积比为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个脱落标签的试剂瓶中,分别盛有盐酸、Ba(OH)2溶液、NaHCO3溶液、Mg(NO3)2溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为A+B混合产生无色气体;B+C混合产生白色沉淀;C+D混合产生白色沉淀;A+C混合无明显变化。
(1)A+C反应的离子方程式为 。
(2)A+B反应的离子方程式为 。
(3) C +D反应的离子方程式为 。
(4)少量B+C反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com