
【题目】25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)===CO(g) ΔH=-393.5 kJ/mol
O2(g)===CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
科目:高中化学 来源: 题型:
【题目】对某酸性溶液(可能含有Br-、SO![]() 、H2SO3、NH
、H2SO3、NH![]() )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热放出的气体可以使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br- B.SO![]() C.H2SO3 D.NH
C.H2SO3 D.NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人生病时要合理用药.下列药品与其作用匹配的是( )
A.氢氧化铝:中和过多胃酸 B.阿司匹林:消炎抗菌
C.青霉素:解热镇痛 D.医用碘酒:人体补碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112ml CO2(标况)。
(1)稀盐酸物质的量浓度为____________。
(2)Na2CO3·xH2O的摩尔质量为_______________。
(3)x=___________。
Ⅱ.在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,化学方程式是:
2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)用“双线桥”标出电子转移的方向和数目。
(2)反应产物中,氧化产物与还原产物的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法正确的是( )
A.福尔马林可用于保存海鲜产品
B.硅胶吸附能力强,常用作催化剂载体和食品干燥剂
C.工业上利用Cl2与澄清石灰水反应制取漂白粉
D.棉花纤维的主要成分是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
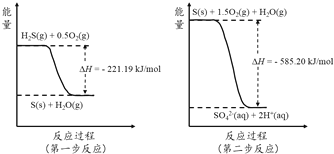
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为
(3)SO2时工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= 。
③8min时,维持温度不变,往反应容器中再通入0.020molSO2(g),0.010molO2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”。)
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化入右图所示:
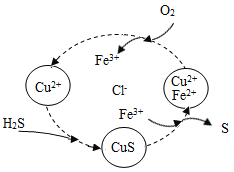
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较安全;相反,如果一个反应的平衡常数夏普与10-5,则认为这个反应很难进行。
已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:Ka1=1.3×10-7,Ka2=7.1×10-15,
通过计算说明反应CuS(s)+2H+(aq)=Cu2+(aq)+H2S(aq)进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表达正确的是
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②向100mL0.1mol/L的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
③因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:IO3-+5I-+3H2O=3I2+6OH-
⑤碳酸氢根离子的电离方程式可表示为:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
A.全部
B.②⑤
C.②③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中能大量共存的是
A. 在含有大量HCO3―的溶液中:K+、Na+、Al3+、Br-
B. 使pH试纸变蓝的溶液中:NH4+、Na+、Cl-、ClO-
C. 含有0.1 mol·L-1 Br—离子的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D. 能使甲基橙变红的溶液中:Na+、K+、SO2-4、AlO-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
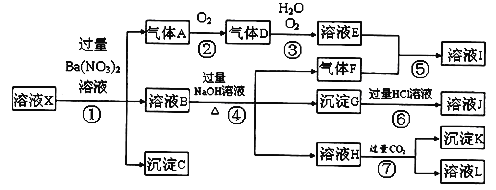
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有:
(2)溶液X中,关于NO3ˉ的判断一定正确的是;
a.一定有
B.一定没有
C.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,
⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com