
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
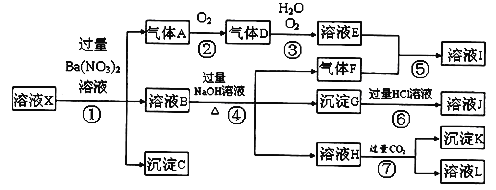
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有:
(2)溶液X中,关于NO3ˉ的判断一定正确的是;
a.一定有
B.一定没有
C.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,
⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
【答案】(1)CO32ˉ、SiO32ˉ(2)b
(3)3Fe2++NO3ˉ+4H+=2Fe3++NO+2H2O
(4)红褐色沉淀溶解,溶液呈黄色
(5)Al3++4OHˉ=AlO2ˉ+2H2O
(6)4:1
(7)②
【解析】试题分析:某强酸性溶液X,则溶液中不存在弱酸根离子CO32-、SiO32-,溶液和硝酸钡溶液反应生成沉淀C,则溶液呈存在SO42-,不存在和硫酸根离子反应的Ba2+,C是BaSO4;酸性条件下硝酸根离子具有强氧化性,所以溶液中Fe2+和NO3-不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+,不存在NO3-,A是NO;溶液B中加入氢氧化钠溶液时,产生气体F,则溶液中含有NH4+,F是NH3,产生沉淀,则溶液中存在Fe3+,沉淀G是Fe(OH)3,氢氧化铁和盐酸反应生成FeCl3,则J是FeCl3,溶液H中通入过量二氧化碳生成沉淀,则溶液中存在Al3+,沉淀K是Al(OH)3,溶液L是NaHCO3;A是NO,则D是NO2,二氧化氮化和水反应生成硝酸和NO,则E是HNO3,硝酸和氨气反应生成硝酸铵,则I是NH4NO3。
(1)由强酸性条件即可判断溶液X中一定不存在弱酸根离子,所以不存在的离子有CO32-、SiO32-;
(2)强酸性溶液中硝酸根离子具有强氧化性,如果存在硝酸根离子,则不存在亚铁离子,加入硝酸钡溶液时不能产生气体,所以溶液X中一定没有NO3-,答案选b;
(3)亚铁离子和硝酸反应生成铁离子、一氧化氮和水,离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)氢氧化铁和稀盐酸反应生成氯化铁和水,氢氧化铁为红褐色沉淀,氯化铁溶液呈黄色,所以看到的现象是:红褐色沉淀逐渐溶解,溶液变为黄色;
(5)铝离子和过量氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为:Al3++4OH-=AlO2-+2H2O;
(6)若转化③中,NO2、H2O、O2三种物质恰好发生化合反应生成HNO3,该反应方程式为:4NO2+2H2O+O2=4HNO3,则反应中D与O2的物质的量之比为4:1;
(7)溶液中铁离子是否存在不能确定,铁离子和硫氰化钾溶液反应生成血红色溶液,所以可以用硫氰化钾溶液检验,答案选②。


科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)===CO(g) ΔH=-393.5 kJ/mol
O2(g)===CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、1个大气压下,将150mLCH4和He的混合气体中与350mLO2混合,点燃并充分反应。
(1)若恢复到原条件,则混合气体的总体积为mL
(2)若再将以上混合气体干燥,得混合气体450mL。则原混合气体中CH4和He的体积比为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol·L-1的稀盐酸。
①该学生需要用量筒量取________mL浓盐酸进行配制。
②实验所用仪器除了烧杯、玻璃棒、量筒还需要用到的玻璃仪器有
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)①假设该同学成功配制了0.400mol·L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取________mL盐酸。(精确到小数点后一位)
②假设该同学用新配制的盐酸中和含0.4gNaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为__________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2 (g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为____________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂,可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2 kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A. 一定有氧元素参加 B. 氧化剂本身发生氧化反应
C. 氧化反应一定先于还原反应发生 D. 一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个脱落标签的试剂瓶中,分别盛有盐酸、Ba(OH)2溶液、NaHCO3溶液、Mg(NO3)2溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为A+B混合产生无色气体;B+C混合产生白色沉淀;C+D混合产生白色沉淀;A+C混合无明显变化。
(1)A+C反应的离子方程式为 。
(2)A+B反应的离子方程式为 。
(3) C +D反应的离子方程式为 。
(4)少量B+C反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1000 ml某无色待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、CO32-、HCO3-、SO42- |
现进行如下实验操作(所加试剂均过量):(已知:NH4+ + OH- (浓)= NH3↑ +H2O)
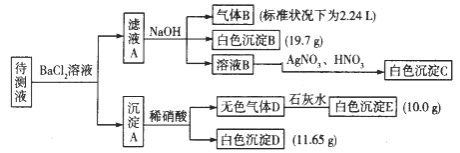
(1)原溶液中肯定存在的离子是(除Na+) ,肯定不存在的离子是 。
(2)写出生成白色沉淀B的离子方程式: 。写出沉淀A溶于稀硝酸的离子方程式:_____________________。
(3)将滤液A和沉淀A分开的操作是过滤,洗涤。洗涤的操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g)当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④
B.①②③
C.②③④
D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com