
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A===HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
科目:高中化学 来源: 题型:单选题
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO 和OH- 和OH- |
| B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C.10 mL0.20mol·L-1CH3COOH溶液加入10 mL0.10mol·L-1的NaOH后,溶液中:c(CH3COO-)+c(CH3COOH)= 0.10mol·L-1 |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,将一元酸HA溶液和NaOH溶液等体积混合,实验数据如表:
| 实验编号 | 起始浓度c(HA) | 起始浓度c(NaOH) | 反应后溶液的pH |
| ① | 0.1 mol·L-1 | 0.1 mol·L-1 | 9 |
| ② | x | 0.2mol·L-1 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知常温下BaSO4的溶解度为2.33×10-4g,类似于水的离子积,难溶盐AmBn也有离子积Ksp且Ksp=〔C(An+)〕m·〔C(Bm-)〕n,,则BaSO4的Ksp约为
| A.2.33×10-4 | B.1×10-5 | C.1×10-10 | D.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
0.1 mol·L-1某酸HA溶液的pH=2,则该溶液中有关浓度关系式正确的是
A.c(H+)>c(A-) B.c(H+)>c(HA) C.c(OH-)>c(HA) D.c(HA)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对滴有酚酞试液的下列溶液,操作后颜色变深的是
| A.明矾溶液加热 | B.CH3COONa溶液加热 |
| C.氨水中加入少量NH4Cl | D.小苏打溶液中加入少量的NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,将1.000 mol·L-1盐酸滴入20.00 mL1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )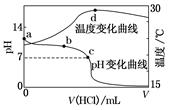
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
| B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(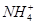 )/c(NH3·H2O)的值增大 )/c(NH3·H2O)的值增大 |
| D.室温下,CH3COOH的KW=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是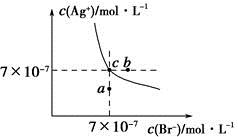
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com