
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是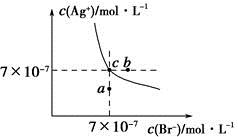
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
科目:高中化学 来源: 题型:单选题
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为
0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
 )>c(S
)>c(S )>c(OH-)
)>c(OH-)查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是
| A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系 |
| C.如上图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为 c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+) |
| D.用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A===HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,对下列电解质溶液的有关说法一定正确的是
| A.相同浓度和体积的强碱和强酸溶液混合后,溶液的pH=7 |
B.在NaHCO3溶液中,c(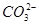 )>c( )>c( ) ) |
| C.在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小 |
| D.将pH相等的CH3COONa和Na2CO3溶液稀释相同倍数,CH3COONa溶液的pH较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法正确的是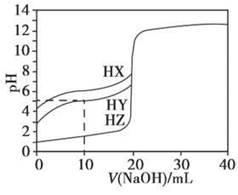
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时:c(H+)= +c(Z-)+c(OH-) +c(Z-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的量浓度关系错误的是
| A.等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
D.0.1 mol·L-1的NaHCO3溶液:c(Na+)>c(OH-)>c(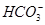 )>c(H+) )>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向盛有1 L 0.1 mol·L-1 NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是
| A.A点时pH=1 |
| B.恰好完全沉淀时Ba(OH)2的体积为2 L |
C.B点时,溶液中的离子浓度关系为c(Na+)>c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| D.C点时pH=14 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:下表为25 ℃时某些弱酸的电离平衡常数。图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |


 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com