
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )

A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下图所示是从铝土矿(主要成分是Al2O3,含Fe2O3、SiO2等杂质)中提取氧化铝的工艺流程之一。

回答下列问题:
(1)用盐酸溶解铝土矿后,所得溶液中的阳离子有_____________;
(2)固体A的主要成分是________;
(3)进行步骤Ⅱ时,为了达到分离要求,加入的NaOH应该_____(填少量或过量)。
(4)进行步骤Ⅲ时,一般通入过量CO2,其反应的离子方程式是________;
(5)溶液X和盐酸反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① 2C(s)+O2(g)=2CO(g);ΔH= -220kJ·mol-1
② 氢气燃烧的能量变化示意图:
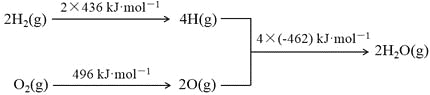
下列说法正确的是
A.1mol C(s)完全燃烧放出110 kJ的热量
B.H2(g)+1/2O2(g)=H2O(g);ΔH= -480kJ·mol-1
C.C(s)+H2O(g)=CO(g)+H2(g);ΔH= +130kJ·mol-1
D.欲分解2mol H2O(l),至少需要提供4×462kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式: 。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
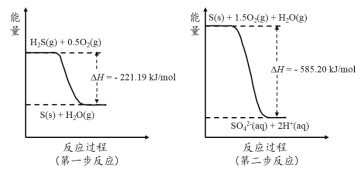
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
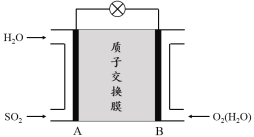
① 质子的流动方向为 (“从A到B”或“从B到A”)。
② 负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
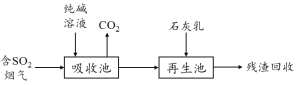
用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。

(1)装置①中反应的化学反应方程式是__________________________。
(2)装置②中的试剂是______(填序号)。
a.饱和Na2CO3溶液 b.饱和NaHCO3溶液 c.浓H2SO4
(3)装置③中的试剂是______________。
进行实验:
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是__________。
(5)过氧化钠跟二氧化碳反应的化学方程式是__________________________。
实验反思:
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是__________________。(答案合理就得分,此空3分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池能量转化的主要形式是____________________________________________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为________________________________________________________________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②金属锂吸收的氢气与放出的氢气的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为:①vA═1mol/(Lmin),②vC═0.5 mol/(Lmin),③vB═0.5 mol/(Lmin),三种情况下该反应速率大小的关系正确的是( )
A. ②>③>①B. ①>②>③C. ③>①>②D. ②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯(F.Haber)从1902年开始研究由氮气和氢气直接合成氨。合成氨为解决世界的粮食问题作出了重要贡献。其原理为N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol
(1)若已知H-H键的键能为436.0kJ/mol,N-H的键能为390.8kJ/mol,则N![]() N的键能约为_____kJ/mol
N的键能约为_____kJ/mol
(2)合成氨反应不加催化剂很难发生,催化剂铁触媒加入后参与了反应降低了活化能。其能量原理如图所示,则加了催化剂后整个反应的速率由______决定(填“第一步反应”或者“第二步反应”),未使用催化剂时逆反应活化能______正反应活化能(填“大于”“小于”或者“等于”)
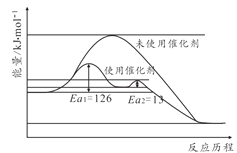
(3)从平衡和速率角度考虑,工业生产采取20MPa到50MPa的高压合成氨原因______
(4)一定温度下恒容容器中,以不同的H2和N2物质的量之比加入,平衡时NH3体积分数如图所示,则H2转化率a点______b点(填"大于”“小于”或者“等于”)。若起始压强为20MPa,则b点时体系的总压强约为______MPa。
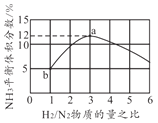
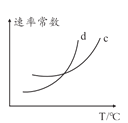
(5)若该反应的正逆反应速率分别表示为v正=K正![]() ,v逆=K逆c2(NH3),则一定温度下,该反应 的平衡常数K=______(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示______和______随温度变化趋势(填K正或者K逆)。
,v逆=K逆c2(NH3),则一定温度下,该反应 的平衡常数K=______(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示______和______随温度变化趋势(填K正或者K逆)。
(6)常温下,向20mL的0.1mol/L的盐酸中通入一定量氨气反应后溶液呈中性(假设溶液体积变化忽略不计)则所得溶液中c(NH4+)=_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)1mol Na2O2固体与水完全反应时转移的电子数_____________,反应的离子方程式为________________。
(2)工业上由辉铜矿生产铜的主要反应为:Cu2S+O2![]() 2Cu+SO2,该反应中被还原的元素是__________(填元素符号)。
2Cu+SO2,该反应中被还原的元素是__________(填元素符号)。
(3)反应(2)中产生的SO2尾气可用NaOH溶液吸收,若用1L 1mol/L的NaOH溶液吸收标准状况下22.4L SO2,反应的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com