
【题目】下图所示是从铝土矿(主要成分是Al2O3,含Fe2O3、SiO2等杂质)中提取氧化铝的工艺流程之一。

回答下列问题:
(1)用盐酸溶解铝土矿后,所得溶液中的阳离子有_____________;
(2)固体A的主要成分是________;
(3)进行步骤Ⅱ时,为了达到分离要求,加入的NaOH应该_____(填少量或过量)。
(4)进行步骤Ⅲ时,一般通入过量CO2,其反应的离子方程式是________;
(5)溶液X和盐酸反应的化学方程式为_______________________。
【答案】Fe3+、Al3+、H+ SiO2 过量 AlO2-+CO2+2H2O===HCO3-+Al(OH)3↓ NaHCO3+HCl===H2O+CO2↑+NaCl
【解析】
铝土矿主要成分是![]() ,含
,含![]() 、
、![]() 杂质,其中氧化铝、氧化铁能和盐酸反应,二氧化硅和盐酸不反应,所以固体A为
杂质,其中氧化铝、氧化铁能和盐酸反应,二氧化硅和盐酸不反应,所以固体A为![]() ,加入氢氧化钠的目的是分离铁离子和铝离子,应该加入过量的氢氧化钠,铁离子生成氢氧化铁沉淀,铝离子生成偏铝酸根,通入二氧化碳后偏铝酸根生成氢氧化铝沉淀,灼烧氢氧化铝生成氧化铝。
,加入氢氧化钠的目的是分离铁离子和铝离子,应该加入过量的氢氧化钠,铁离子生成氢氧化铁沉淀,铝离子生成偏铝酸根,通入二氧化碳后偏铝酸根生成氢氧化铝沉淀,灼烧氢氧化铝生成氧化铝。
(1)铝土矿主要成分是![]() ,含
,含![]() 、
、![]() 杂质,其中氧化铝、氧化铁能和盐酸反应,二氧化硅和盐酸不反应,且盐酸过量,故所得溶液中的阳离子有铝离子、铁离子和氢离子,
杂质,其中氧化铝、氧化铁能和盐酸反应,二氧化硅和盐酸不反应,且盐酸过量,故所得溶液中的阳离子有铝离子、铁离子和氢离子,
故答案为:![]() ;
;
(2)二氧化硅和盐酸不反应,所以固体A为![]() ,
,
故答案为:![]() ;
;
(3)加入氢氧化钠的目的是分离铁离子和铝离子,应该加入过量的氢氧化钠,铁离子生成氢氧化铁沉淀,铝离子生成偏铝酸根,
故答案为:过量;
(4)通入过量![]() 后,偏铝酸根生成氢氧化铝沉淀,
后,偏铝酸根生成氢氧化铝沉淀,![]() 过量所以生成碳酸氢根,离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
过量所以生成碳酸氢根,离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(5)溶液X为碳酸氢钠溶液,和盐酸反应的方程式为:NaHCO3+HCl=H2O+CO2↑+NaCl,
故答案为:NaHCO3+HCl=H2O+CO2↑+NaCl。


科目:高中化学 来源: 题型:
【题目】原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请你回答下列问题:
(1)请按要求任意写一个相应物质:(填化学式)含有非极性键的离子化合物________,既含有非极性键又含极性键的非极性分子________,既含有非极性键又含极性键的极性分子________,全部由非金属元素组成的离子化合物________,由金属元素和非金属元素组成的共价化合物________。
(2)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4种类型,苏丹红Ⅰ的分子结构如图所示。


苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图所示的结构,则其在水中的溶解度会________(填“增大”或“减小”),原因是_____________________________________。
(3)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为________________,由Cl-所形成的化学键类型是________。
(4)下图中A,B,C,D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是________;表示ⅣA族元素氢化物沸点的曲线是________;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是_____________________________;A,B,C曲线中第二周期元素的氢化物的沸点显著高于第三周期元素的氢化物的沸点,其原因是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生活中 Na2CO3和NaHCO3都可作食用碱。下列对其性质的描述用化学方程式或离子方程式表示正确的是
A.NaHCO3可作发酵粉:2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
B.饱和Na2CO3溶液中通入CO2: CO32- +CO2+ H2O → HCO3-
C.Na2CO3溶液呈碱性:CO32-+ 2H2O → H2CO3+ 2OH-
D.饱和Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32- + 2H+ →CO2↑ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
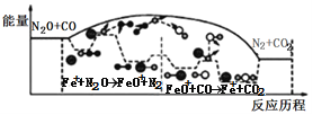
A.反应总过程是放热的
B.Fe+作为催化剂改变了反应途径,提高了反应速率
C.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 两步反应均为放热反应
D.若反应在恒容密闭容器中进行,温度越高,反应速率一定越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C.所含的电子数由多到少的顺序是:SO2>CO2>O2>CH4>H2
D.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应2A(g)+2B(g)![]() 3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
A. 单位时间内生成2n molB,同时消耗3n molCB. 容器内压强不随时间变化
C. 混合气体的密度不随时间变化D. B物质的百分含量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
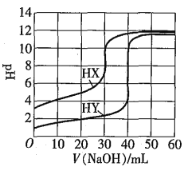
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.9 g镁铝合金投入到500 mL 2 mol/L的硫酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入NaOH溶液的体积是
A. 125 mL B. 200 mL C. 250 mL D. 500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )

A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com