
【题目】在一定条件下,反应2A(g)+2B(g)![]() 3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
A. 单位时间内生成2n molB,同时消耗3n molCB. 容器内压强不随时间变化
C. 混合气体的密度不随时间变化D. B物质的百分含量不变
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如下装置制取和验证SO2的性质
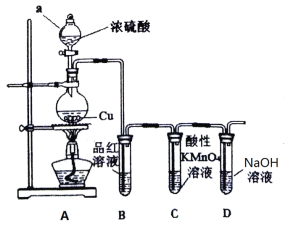
请回答:
(1)图中仪器a的名称为_____________。
(2)A中发生反应的化学方程式是_____________________________________。
(3)若C中溶液褪色,体现SO2具有_________________性。
(4)过量NaOH溶液与SO2反应的离子方程式是__________________________________。
(5)向两支装有品红溶液的试管中,分别通入Cl2和SO2,发现两支试管中品红溶液均褪色,请你设计实验证明哪支试管中通入的是SO2:_________________。
(6)该小组继续设计实验,相同条件下将Cl2和SO2两种气体按体积1:1混合,再通入品红溶液中,观察溶液几乎不褪色。查阅资料知:两种气体按体积1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
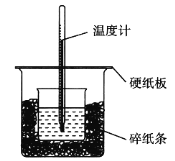
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是从铝土矿(主要成分是Al2O3,含Fe2O3、SiO2等杂质)中提取氧化铝的工艺流程之一。

回答下列问题:
(1)用盐酸溶解铝土矿后,所得溶液中的阳离子有_____________;
(2)固体A的主要成分是________;
(3)进行步骤Ⅱ时,为了达到分离要求,加入的NaOH应该_____(填少量或过量)。
(4)进行步骤Ⅲ时,一般通入过量CO2,其反应的离子方程式是________;
(5)溶液X和盐酸反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小、b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2和浓盐酸制氯气的反应为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g MnO2被还原,那么:
MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g MnO2被还原,那么:
(1)产生的Cl2在标准状况下的体积为__________;
(2)转移电子的物质的量为_______________;
(3)纺织工业中常用氯气作漂白剂,漂白布匹后,过量的氯需要除去,通常可用Na2SO3作“脱氯剂”,脱氯后的产物为Na2SO4,氯变为-1价。若把本题中产生的Cl2完全转化,需要Na2SO3的质量为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:
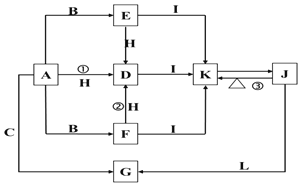
请按要求书写:
(1)反应①的离子方程式: ____________________________________;
(2)物质K与物质L等物质的量离子方程式:___________________________;
(3)物质F转化为D的离子方程式:___________________________________;
(4)物质G向物质J转化的化学方程式:_______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池能量转化的主要形式是____________________________________________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为________________________________________________________________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②金属锂吸收的氢气与放出的氢气的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com