
【题目】有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小、b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞共用。金原子的直径为dcm,用NA表示阿伏加德罗常数,M表示金的摩尔质量(单位:g·mol-1)。
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_________。
(3)一个晶胞的体积为________cm3。
(4)金晶体的密度为________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是生活中常见的物质,请回答下列问题:
(1)写出纯碱在水溶液中电离的方程式:_________。
(2)纯碱属于“酸”“碱”“盐”中的_____。
(3)现有 10.6 g 纯碱,其物质的量为__________mol,将此固体溶于水配成 200 mL 溶液,其溶质的物 质的量浓度为_________ mol·L-1,取出 10 mL 此溶液加水稀释至 100 mL,其溶质的物质的量浓度 为___ mol·L-1,稀释后溶液中 Na+的物质的量为________ mol。
(4)①写出少量 CO2 与 NaOH 溶液反应的离子方程式: _____________
②写出过量 CO2 与 NaOH 溶液反应的离子方程式: _________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 萘(![]() )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
)是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
B. 酚酞的结构如图所示,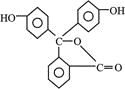 其结构中含有羟基(—OH),故酚酞属于醇
其结构中含有羟基(—OH),故酚酞属于醇
C. 溴水能将甲苯、己烯、CCl4、乙醇四种溶液鉴别开来
D. ![]() 的名称为2-甲基-4-戊醇
的名称为2-甲基-4-戊醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应2A(g)+2B(g)![]() 3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
A. 单位时间内生成2n molB,同时消耗3n molCB. 容器内压强不随时间变化
C. 混合气体的密度不随时间变化D. B物质的百分含量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
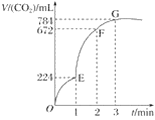
A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D. G点表示收集的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。
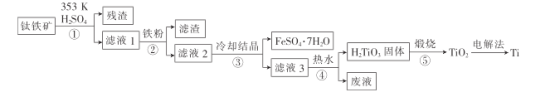
(1)步骤②、③、④中,均需进行的操作是_____________(填操作名称)。
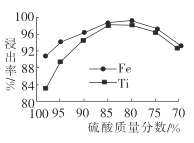
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______(填范围)。.
(3)请结合离子方程式解释步骤④中加热水的原因:__________。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:
![]()
①绿矾溶液中离子浓度由大到小的顺序为__________。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
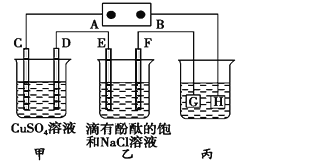
(1) A为电源的_____极,写出甲中C的电极反应式________。
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为__。
(3) 现用丙装置给铜件镀银,电镀液是______溶液。当乙中溶液的c(OH-)=0.1 molL1时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为___。
(4) 若将F电极更换为铁,其他装置都不变,则乙中发生总反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒研究提出的苯分子结构模型如图所示:
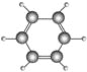
(1)请根据苯的分子结构模型,写出苯的分子式_______,结构式____________,结构简式________________。
(2)向试管中加入3 mL酸性高锰酸钾溶液,再加入1 mL苯,振荡试管。观察到的实验现象是_______________。
(3)向试管中加入1 mL溴水,再加入3 mL苯,振荡试管。观察到的实验现象是_____________。
(4)你认为凯库勒提出的苯的分子结构符合实验事实吗?________,理由是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com